题目内容
在一定温度和体积为2L的密闭容器中发生下列反应:N2(g)+3H2(g)?2NH3(g)起始时N2和H2的物质的量分别为1mol、4mol.2S末时,测定N2的物质的量为0.8mol,则用H2的浓度变化表示的化学反应速率为( )
| A、0.1mol/L?S |
| B、0.3mol/L?S |
| C、0.15mol/L?S |
| D、0.9mol/L?S |
考点:反应速率的定量表示方法
专题:化学反应速率专题
分析:化学反应速率:用单位时间内反应物浓度的减少或生成物浓度的增加来表示,根据化学反应速率的定义进行计算.
解答:
解:△n(N2)=1mol-0.8mol=0.2mol,由N2(g)+3H2(g)?2NH3(g)可知,则△n(H2)=0.2mol×3=0.6mol,v(H2)=
=
=0.15mol/L?S,
故选C.
| ||
| t |
| ||
| 2s |
故选C.
点评:本题考查化学反应速率的相关计算,把握化学反应速率的定义为解答的关键,难度不大.

练习册系列答案
相关题目
 如图所示装置中加入一定的铁粉,分液漏斗中加入一定体积浓度为l2mol?L-1的HNO3,加热并打开分液漏斗的活塞,使其充分反应后,下列微粒在该装置中一定大量存在的是( )
如图所示装置中加入一定的铁粉,分液漏斗中加入一定体积浓度为l2mol?L-1的HNO3,加热并打开分液漏斗的活塞,使其充分反应后,下列微粒在该装置中一定大量存在的是( )①NO3- ②Fe3+③H+④NO ⑤NO2.
| A、①⑤ | B、① |
| C、②④⑤ | D、①②④⑤ |
下列对于乙烯(CH2=CH2)分子结构的描述中正确的是( )
| A、有6个σ键、0个π键 |
| B、3个sp3杂化轨道形成σ键、1个sp3杂化轨道形成π键 |
| C、C-H之间是s轨道与sp2轨道形成的σ键,C与C之间是未参加杂化的2p轨道形成的σ键和π键 |
| D、C与C之间是sp2杂化轨道形成的一个σ键和未参加杂化的2p轨道形成的π键 |
在同温同压下,下列各组热化学方程式中 Q2>Q1的是( )
| A、2H2(g)+02(g)=2H20(g);△H1=-Q1 2H2(g)+02(g)=2H20(1);△H2=-Q2 | ||||
| B、S(g)+O2(g)=S02(g);△H1=-Q1 S(s)+02(g)=S02(g);△H2=-Q2 | ||||
C、C(s)+
C(s)+02(g)=C02(g);△H2=-Q2 | ||||
D、H2(g)+Cl2(g)=2HCl(g);△H1=-Q1
|
实验室区别下列物质选用的试剂(括号中的为试剂,必要时可加热)不正确的是( )
| A、苯和己烯 (溴水) |
| B、矿物油和植物油 (NaOH溶液) |
| C、乙醛和乙酸 (银氨溶液) |
| D、硝基苯和CCl4(水) |
 :
: :
: :
: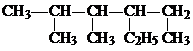 的名称是
的名称是 化合物A中含氧官能团的名称
化合物A中含氧官能团的名称