题目内容
16.用50mL1.0mol/L盐酸与50mL1.1mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒.该用品能否用铁质用品代替不能,原因是①铁的导热系数大,容易散热;②铁会与盐酸反应
(2)图示中用品填加后的装置叫量热器.
(3)烧杯间填满碎纸条的作用是保温,减少热量的散失.
(4)大烧杯上如不盖硬纸板,求得的中和热数值偏小(填“偏大、偏小、无影响”).
(5)如果用60mL1.0mol/L盐酸与50mL1.1mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等、不相等”),所求中和热相等(填“相等、不相等”).已知在稀溶液中强酸与强碱发生中和反应生成1mol水时放出57.3kJ的热量,写出上述反应的热化学方程式NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ/mol
(6)用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会偏小;(填“偏大”、“偏小”、“无影响”).
(7)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和.试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热数值偏低(填偏高、偏低或不变);
(8)该实验小组做了三次实验,每次取溶液各50mL,并记录如表原始数据.
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
分析 (1)根据量热计的构造来判断该装置的缺少仪器;根据金属棒是热的良导体,易传热,而且能与盐酸反应;
(2)通过量热器测定反应过程中所放出的热量可计算中和热;
(3)中和热测定实验成败的关键是保温工作;
(4)不盖硬纸板,会有一部分热量散失;
(5)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;根据物质的物质的量与热量之间的关系以及热化学方程式的书写方法书写;
(6)根据弱电解质电离吸热分析;
(7)根据少量盐酸在反应中挥发,反应的盐酸偏少,放出的热量偏小;
(8)先求出三次反应的温度差,根据公式Q=cm△T来求出生成0.05mol的水放出热量,最后根据中和热的概念求出中和热;
解答 解:(1)根据量热计的构造来判断该装置的缺少仪器为环形玻璃搅拌棒;铁质搅拌棒的导热性好,易传热,散发热量,所得中和热的测定值比理论值偏低,而且铁会与盐酸反应;
故答案为:环形玻璃搅拌棒;不能;铁的导热系数大,容易散热;铁会与盐酸反应;
(2)图示中用品填加后的装置叫量热器,量热器能测定反应过程中所放出的热量从而计算中和热;
故答案为:量热器;
(3)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是保温,减少实验过程中的热量损失,
故答案为:保温,减少热量的散失;
(4)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,
故答案为:偏小;
(5)反应放出的热量和所用酸以及碱的量的多少有关,如果用60mL1.0mol/L盐酸与50mL1.1mol/LNaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但中和热是强酸和强碱反应生成1mol水时放出的热量,与酸碱的用量无关;在稀溶液中强酸与强碱发生中和反应生成1mol水时放出57.3kJ的热量,则反应的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ/mol;
故答案为:不相等;相等;NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ/mol
(6)NH3•H2O为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量偏小,求得的中和热数值将会减小,
故答案为:偏小;
(7)少量盐酸在反应中挥发,盐酸挥发吸收热量,且盐酸偏少,放出的热量偏小,测得的中和热数值偏低;
故答案为:偏低;
(8)三次前后温度差分别为:6.6℃,6.7℃,6.8℃,均有效,平均值为$\frac{6.6℃+6.7℃+6.8℃}{3}$=6.7℃,50mL1.0mol/L盐酸与50mL1.1mol/LNaOH溶液的质量和为100mL×1g/mL=100g,c=4.18J/(g•℃),代入公式Q=cm△T得生成0.05mol的水放出热量Q=4.18J/(g•℃)×100g×6.7℃=28.006KJ,即生成0.5mol的水放出热量28.006KJ,所以生成1mol的水放出热量为28.006KJ×2=56.01kJ,即该实验测得的中和热△H=-56.0kJ/mol;
故答案为:-56.0kJ/mol;
点评 本题考查热化学方程式以及反应热的计算,注意理解中和热的概念以及测定反应热的误差等问题,掌握实验原理即可解答,难度不大.

 培优三好生系列答案
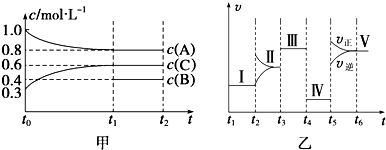
培优三好生系列答案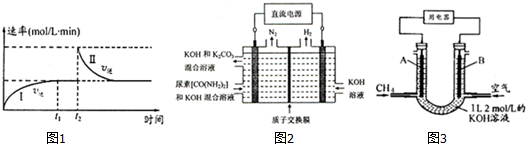
a.0~t1时,v正>v逆,t2时,v逆>v正
b.混合气体的密度不再改变时,Ⅰ、Ⅱ两过程达到平衡
c.t2时刻改变的条件可以是向密闭容器中加C
d.Ⅰ、Ⅱ两过程达到平衡时,平衡常数Ⅰ<Ⅱ
(2)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].
CO2(g)+2NH3(g)$\stackrel{一定条件}{?}$CO(NH2)2(1)+H2O(g)△H<0
t℃时,向容积恒定为2L的密闭容器中加入0.10molCO2和0.40molNH3,70min开始达到平衡.反应中CO2( g)的物质的量随时间变化如表所示:
| 时间/min | 0 | 20 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.020 | 0.020 | 0.020 |
②在100min时,保持其它条件不变,再向容器中充入0.050mo1CO2和0.20molNH3,重新建立平衡后CO2的转化率与原平衡相比将增大(填“增大”、“不变”或“减小”).
③上述可逆反应的平衡常数为277.8(保留一位小数).
④图2所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气.该装置中阳极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O,
(3)CH4燃料电池,装置示意如图3(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.当 V=44.8L时,电池总反应方程式为CH4+2O2+KOH=KHCO3+2H2O.
 +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$ +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O +HCl→
+HCl→ +KCl
+KCl实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.

已知:苯甲酸分子量是122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物一般都有固定熔点.
(1)操作Ⅰ为分液,操作Ⅱ为蒸馏.
(2)无色液体A是甲苯,定性检验A的试剂是酸性KMnO4溶液,现象是溶液褪色.
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔.该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,溶解 冷却、过滤, | 得到白色晶体和无色溶液 | -- |
| ② | 取少量滤液于试管中,滴入2-3滴AgNO3溶液 | 生成白色沉淀 | 滤液含有Cl- |
| ③ | 干燥白色晶体,加热使其融化,测其熔点 | 熔点为122.4℃ | 白色晶体是苯甲酸 |
| A. | 锗可用于制造半导体材料 | |
| B. | RbOH的碱性强于Ca(OH)2 | |
| C. | SrCO3是白色难溶于水易溶于盐酸的化合物 | |
| D. | 砹化银(AgAt)是白色难容于稀硝酸的化合物 |

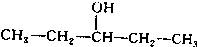 .
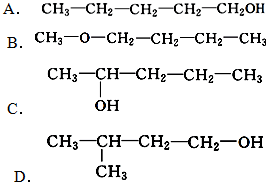
.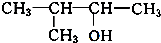 、
、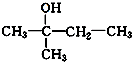 写出另外两种同分异构体的结构简式:
写出另外两种同分异构体的结构简式: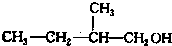 、
、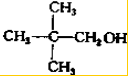 .
.