题目内容
17.已知X为FeO和CuO的混合物,取两份等质量的X样品进行下列实验:设第3步所得固体D的质量为 32g,溶液E中只含有一种金属离子,气体F在标准状况下体积为5.6 L,则X中FeO与CuO的物质的 量之比为( )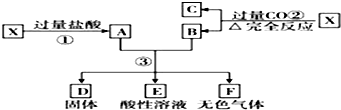
| A. | 4:1 | B. | 1:2 | C. | 2:1 | D. | 1:1 |
分析 FeO可与盐酸反应生成氯化亚铁和水,CuO可与盐酸反应生成氯化铜和水,FeO、CuO都能与CO反应,分别生成铁、铜及二氧化碳.据此可判断A为氯化亚铁、氯化铜及剩余盐酸的混合溶液,固体B则为铁、铜的混合物.A、B混合时铁与氯化铜及盐酸继续反应,得到氯化亚铁、铜和氢气,由于反应后所得溶液E中仍有剩余的盐酸且只含有一种金属离子,可判断出固体B中铁、A中的氯化铜完全反应,固体D全部为铜;根据变化前后元素质量不变,由固体D铜的质量,可求得混合物X中CuO的质量,由与铁反应生成铜、氢气的质量,可计算出固体B中铁的质量,最后根据质量守恒定律计算出X中FeO与CuO的物质的量之比.
解答 解:X为FeO和CuO的混合物,由转化关系可知,A中含HCl、FeCl2、CuCl2,B中含Fe、Cu,C为CO2,B与A反应生成F为H2,还原性Fe>Cu,则Fe与A中阳离子反应,固体D为Cu,E为一定含FeCl2,
所得固体D的质量为32g,溶液E中只含一种金属离子,气体F在标准状况下体积为5.6L,
由Fe+2H+═Fe2++H2↑,可知与盐酸反应的Fe的质量为:56g/mol×$\frac{5.6L}{22.4L/mol}$mol-1=14g,
由题意可知一份X中含Cu的质量为32 g÷2=16 g,则每份中CuO的物质的量为:n(CuO)=n(Cu)=$\frac{16g}{64g/mol}$=0.25mol;
由 Cu2++Fe═Fe2++Cu 差量
64 56 8
16g
得16 g Cu2+与Fe反应的差量为:8g×0.25=2 g,
与16 g Cu2+反应的Fe的质量为:$\frac{56×2}{8}$=14 g,
所以一份X中含Fe的质量为14 g+14g=28 g,根据质量守恒可知:n(FeO)=n(Fe)=$\frac{28g}{56g/mol}$=0.5mol,
X中FeO与CuO的物质的量之比为:0.5mol:0.25mol=2:1,
故选C.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握物质的量与摩尔质量之间的关系,试题侧重考查学生的分析、理解能力及逻辑推理能力.

 阅读快车系列答案
阅读快车系列答案
a.0~t1时,v正>v逆,t2时,v逆>v正
b.混合气体的密度不再改变时,Ⅰ、Ⅱ两过程达到平衡
c.t2时刻改变的条件可以是向密闭容器中加C
d.Ⅰ、Ⅱ两过程达到平衡时,平衡常数Ⅰ<Ⅱ
(2)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].
CO2(g)+2NH3(g)$\stackrel{一定条件}{?}$CO(NH2)2(1)+H2O(g)△H<0
t℃时,向容积恒定为2L的密闭容器中加入0.10molCO2和0.40molNH3,70min开始达到平衡.反应中CO2( g)的物质的量随时间变化如表所示:
| 时间/min | 0 | 20 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.020 | 0.020 | 0.020 |
②在100min时,保持其它条件不变,再向容器中充入0.050mo1CO2和0.20molNH3,重新建立平衡后CO2的转化率与原平衡相比将增大(填“增大”、“不变”或“减小”).
③上述可逆反应的平衡常数为277.8(保留一位小数).
④图2所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气.该装置中阳极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O,
(3)CH4燃料电池,装置示意如图3(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.当 V=44.8L时,电池总反应方程式为CH4+2O2+KOH=KHCO3+2H2O.
| A. | M<N | B. | 2M=N | C. | N<M | D. | M=N |
| A. | 两种元素组成的分子中所含化学键一定都是极性键 | |
| B. | 金属晶体的熔点一定比分子晶体的高 | |
| C. | 某晶体中含有阳离子,则一定也含有阴离子 | |
| D. | 含有阴离子的化合物一定含有阳离子 |
| A. | 铁与稀硫酸反应制取H2后的溶液中:Na+、K+、AlO2-、Br- | |
| B. | 银氨溶液:Na+、K+、NO3-、NH3•H2O | |
| C. | 苯酚钠溶液:H+、HCO3-、SO2、K+ | |
| D. | 氢氧化铝胶体:H+、K+、S2-、SO32- |


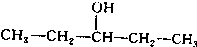 .
.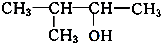 、
、 写出另外两种同分异构体的结构简式:
写出另外两种同分异构体的结构简式: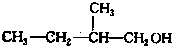 、
、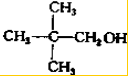 .
.