题目内容
取两个相同容积的密闭恒容容器,在A容器中充入0.2molN2O4,B容器中充入0.2molHI气体,在一定温度下时反应分别达到平衡,测得N2O4和HI的分解率分别为α(A)和α(B).在该平衡体系中再分别充入0.2molN2O4和0.2molHI,当反应重新达到平衡时,测得N2O4和HI的分解率分别为α′(A)和α′(B).下列判断一定正确的是( )
| A、α(A)=α(B) |
| B、α(A)>α′(A) |
| C、α(B)=α′(B) |
| D、α(A)=α′(A) |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:A容器中N2O4?2NO2,B容器中2HI(g)?H2(g)+I2(g),恒容容器中,再充入0.2molN2O4和0.2molHI,容器内压强增大,A中正反应气体体积增大,反应物转化率降低,B中反应前后气体体积不变,转化率不变,据此分析.
解答:
解:A容器中N2O4?2NO2,B容器中2HI(g)?H2(g)+I2(g),恒容容器中,再充入0.2molN2O4和0.2molHI,容器内压强增大,A中正反应气体体积增大,反应物转化率降低,B中反应前后气体体积不变,转化率不变,
A、A中正反应气体体积增大,B中反应前后气体体积不变,相同条件下,A中反应物转化率比B低,α(A)<α(B),故A错误;
B、A中正反应气体体积增大,恒容容器中,再充入0.2molN2O4反应物转化率降低,所以α(A)>α′(A),故B正确;
C、B中反应前后气体体积不变,恒容容器中,再充入0.2molHI,转化率不变,故C正确;
D、A中正反应气体体积增大,恒容容器中,再充入0.2molN2O4反应物转化率降低,所以α(A)>α′(A),故D错误;
故选BC.
A、A中正反应气体体积增大,B中反应前后气体体积不变,相同条件下,A中反应物转化率比B低,α(A)<α(B),故A错误;
B、A中正反应气体体积增大,恒容容器中,再充入0.2molN2O4反应物转化率降低,所以α(A)>α′(A),故B正确;
C、B中反应前后气体体积不变,恒容容器中,再充入0.2molHI,转化率不变,故C正确;
D、A中正反应气体体积增大,恒容容器中,再充入0.2molN2O4反应物转化率降低,所以α(A)>α′(A),故D错误;
故选BC.
点评:本题以二氧化氮和四氧化二氮的可逆反应以及碘化氢的分解反应为载体考查了化学平衡移动原理,要注意:压强只对反应前后气体体积改变的可逆反应平衡移动有影响,对反应前后气体体积不变化的可逆反应无影响,但压强对所有有气体参加的可逆反应反应速率都有影响,无论反应前后气体体积是否变化.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2011年1月14日,我国材料科学的一代宗师师昌绪,荣获2010年度中国科技界的最高荣誉“国家最高科学技术奖”,他主要从事高温合金及高合金钢研究,领导研制出我国第一代空心气冷铸造镍基高温合金涡轮叶片等多项成果,下列关于合金的叙述正确的是( )
| A、合金的熔点一般比组分金属高 |
| B、合金中只含金属元素 |
| C、合金的机械性能一般比组分金属好 |
| D、合金不容易发生电化学腐蚀 |
在无色透明的溶液中可以大量共存的离子组是( )
| A、H+、K+、Fe2+、NO3- |
| B、OH-、Cl-、Na+、NH4+ |
| C、Mg2+、K+、Cl-、NO3- |
| D、I-、Cl-、H+、Fe3+ |

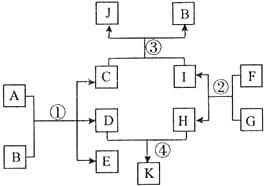 在如图所示的物质转化关系中(反应条件已略去).A是海水中含量最多的盐,B是最常见的无色液体,D、E、F、H为单质.反应①是海水资源综合利用的重要反应,反应②常用于钢轨的焊接,工业上用C与D反应制备漂白液.
在如图所示的物质转化关系中(反应条件已略去).A是海水中含量最多的盐,B是最常见的无色液体,D、E、F、H为单质.反应①是海水资源综合利用的重要反应,反应②常用于钢轨的焊接,工业上用C与D反应制备漂白液.
 如图所示装置中,观察到电流计指针偏转;M棒变粗,N棒变细.由此判断下表中所列M、N、P物质,其中可以成立的是( )
如图所示装置中,观察到电流计指针偏转;M棒变粗,N棒变细.由此判断下表中所列M、N、P物质,其中可以成立的是( )