题目内容
在无色透明的溶液中可以大量共存的离子组是( )
| A、H+、K+、Fe2+、NO3- |
| B、OH-、Cl-、Na+、NH4+ |
| C、Mg2+、K+、Cl-、NO3- |
| D、I-、Cl-、H+、Fe3+ |
考点:离子共存问题
专题:离子反应专题
分析:根据离子之间不能结合生成水、气体、沉淀等,则离子能大量共存,并结合离子的颜色来解答.
解答:
解:A.H+、Fe2+、NO3-发生氧化还原反应而不能大量共存,故A错误;
B.OH-、NH4+反应生成弱电解质一水合氨而不能大量共存,故B错误;
C.溶液无色,且离子之间不发生任何反应,可大量共存,故C正确;
D.I-、Fe3+发生氧化还原反应而不能大量共存,故D错误.
故选C.
B.OH-、NH4+反应生成弱电解质一水合氨而不能大量共存,故B错误;
C.溶液无色,且离子之间不发生任何反应,可大量共存,故C正确;
D.I-、Fe3+发生氧化还原反应而不能大量共存,故D错误.
故选C.
点评:本题考查离子共存问题,为高考常见题型,侧重于元素化合物知识的综合考查和学生的分析能力、审题的能力的考查,注意把握常见离子的性质以及反应类型的判断,题目难度不大.

练习册系列答案
相关题目
下列物质属于天然高分子化合物的是( )
| A、油脂 | B、塑料 | C、淀粉 | D、葡萄糖 |
取两个相同容积的密闭恒容容器,在A容器中充入0.2molN2O4,B容器中充入0.2molHI气体,在一定温度下时反应分别达到平衡,测得N2O4和HI的分解率分别为α(A)和α(B).在该平衡体系中再分别充入0.2molN2O4和0.2molHI,当反应重新达到平衡时,测得N2O4和HI的分解率分别为α′(A)和α′(B).下列判断一定正确的是( )
| A、α(A)=α(B) |
| B、α(A)>α′(A) |
| C、α(B)=α′(B) |
| D、α(A)=α′(A) |
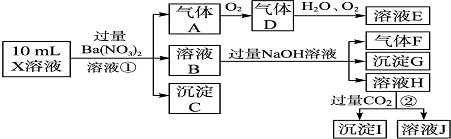
海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法正确的是( )
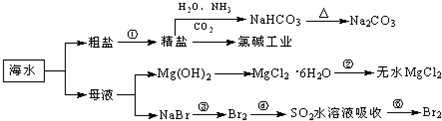

| A、制取NaHCO3的反应是利用其溶解度小于NaCl |
| B、用澄清的石灰水可鉴别NaHCO3溶液和Na2CO3溶液 |
| C、在第③、④、⑤步骤中,溴元素均被氧化 |
| D、加热MgCl2溶液制取无水氯化镁 |
光纤通信是以光作为信息的载体,制造光导纤维的基本原料是( )
| A、钢 | B、铜 | C、石英砂 | D、铝 |
下列化学式只表示一种纯净物的是( )
| A、C3H8 |
| B、C4H10 |
| C、C3H7Cl |
| D、C2H4Cl2 |