题目内容
第二周期元素A和B能形成键角为180°的AB2气体分子,则下列推断不正确的是( )
| A、AB2分子的空间构型为直线形 |
| B、AB2分子为极性分子 |
| C、熔点、沸点:AB2<H2O |
| D、AB2与SiO2所属的晶体类型不相同 |
考点:元素周期律的作用,键能、键长、键角及其应用
专题:化学键与晶体结构
分析:根据第二周期元素A和B能形成键角为180°的AB2气体分子,判断出该分子为二氧化碳,依此结合选项进行判断.
解答:
解:第二周期元素A和B能形成键角为180°的AB2气体分子,故该分子可能为二氧化碳,
A.二氧化碳分子的空间构型为直线形,故A正确;
B.二氧化碳分子为非极性分子,故B错误;
C.水中含有氢键,故熔点、沸点:CO2<H2O,故C正确;
D.CO2为分子晶体,SiO2为原子晶体,故D正确;
故选B.
A.二氧化碳分子的空间构型为直线形,故A正确;
B.二氧化碳分子为非极性分子,故B错误;
C.水中含有氢键,故熔点、沸点:CO2<H2O,故C正确;
D.CO2为分子晶体,SiO2为原子晶体,故D正确;
故选B.
点评:本题考查二氧化碳的空间构型、分子的极性、晶体的类型及氢键的性质,难度不大.要注意氢键的存在使得物质的熔沸点偏高.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
某链状有机物分子中含有m个-CH3,n个-CH2-,a个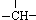 ,其余为-NH2,则-NH2的数目可能是( )
,其余为-NH2,则-NH2的数目可能是( )
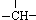 ,其余为-NH2,则-NH2的数目可能是( )
,其余为-NH2,则-NH2的数目可能是( )| A、2n+3-m |
| B、a+2-m |
| C、n+m+a |
| D、a+2n+2-m |
某烯烃的结构简式为: ,其命名正确的是( )
,其命名正确的是( )
 ,其命名正确的是( )
,其命名正确的是( )| A、2甲基4乙基4戊烯 |
| B、2异丁基1丁烯 |
| C、2,4二甲基3己烯 |
| D、4甲基2乙基1戊烯 |
已知X、Y、Z都是短周期元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相等,而Z原子的最外层电子数是次外层的3倍,Y和Z可以形成两种以上气态化合物,则下列说法错误的是( )
| A、Y和Z可以组成一种Y和Z的质量比为7:20的化合物 |
| B、X和Y可以组成原子个数比分别为3:1和2:1的两种化合物 |
| C、X、Y、Z可以组成一种盐,其中X、Y、Z元素原子个数比为4:2:3 |
| D、由X、Y、Z三种元素中的任意两种组成的具有10电子的微粒只有2种 |
下列说法中不正确的是( )
| A、元素的第一电离能是元素的单质失去最外层1个电子所需要吸收的能量,同周期从左到右元素的电离能逐渐增大 |
| B、元素的电负性是衡量元素在化合物中吸引电子能力大小的一种标度,同主族从上到下元素的电负性逐渐减小 |
| C、元素的性质随着原子序数的增大而呈周期性变化 |
| D、鲍林的电负性是以氟的电负性为4.0和锂的电负性为1.0作为相对标准得出的 |
下列各组溶液中,c(NO3-) 与200mL 0.2mol/L NaNO3溶液中的c(NO3-) 相同的是( )
| A、100mL 0.4mol/L KNO3溶液 |
| B、100mL 0.2mol/L Cu(NO3)2溶液 |
| C、200mL 0.1mol/L Fe(NO3)2溶液 |
| D、400mL 0.1mol/L Al(NO3)3溶液 |
下列根据反应原理设计的应用,不正确的是( )
| A、CO32-+H2O?HCO3-+OH- 热的纯碱溶液清洗油污 |
| B、Al3++3H2O?Al(OH)+3H+明矾净水 |
| C、TiCl4+(x+2)H2O(过量)?TiO2?xH2O↓+4HCl 用TiCl制备TiO |
| D、SnCl2+H2O?Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠 |
在2H2S+SO2═2H2O+3S中氧化产物与还原产物质量之比为( )
| A、2:1 | B、1:2 |
| C、3:2 | D、2:3 |
常温下,在溶液中可发生以下反应:由此判断下列说法错误的是( )
①16H++10Z-+2XO4-═2X2++5Z2+8H2O;
②2M2++R2═2M3++2R-;
③2R-+Z2═R2+2Z-.
①16H++10Z-+2XO4-═2X2++5Z2+8H2O;
②2M2++R2═2M3++2R-;
③2R-+Z2═R2+2Z-.
| A、常温下可发生反应2M2++Z2═2M3++2Z- |
| B、还原性强弱顺序为:X2+<Z-<R-<M2+ |
| C、Z元素在反应①中被氧化,在③中被还原 |
| D、氧化性强弱顺序为:XO4-<Z2<R2<M3+ |