题目内容
已知X、Y、Z都是短周期元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相等,而Z原子的最外层电子数是次外层的3倍,Y和Z可以形成两种以上气态化合物,则下列说法错误的是( )
| A、Y和Z可以组成一种Y和Z的质量比为7:20的化合物 |
| B、X和Y可以组成原子个数比分别为3:1和2:1的两种化合物 |
| C、X、Y、Z可以组成一种盐,其中X、Y、Z元素原子个数比为4:2:3 |
| D、由X、Y、Z三种元素中的任意两种组成的具有10电子的微粒只有2种 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:X、Y、Z都是短周期元素,它们的原子序数依次递增,Z原子的最外层电子数是次外层的3倍,只能有2个电子层,最外层电子数为6,则Z是O元素;X原子的电子层数与它的核外电子总数相等,且原子序数小于Z,所以X是H元素;Y和Z可以形成两种以上气态化合物,且Y原子序数小于Z,则Y为碳元素或氮元素,据此解答.
解答:
解:X、Y、Z都是短周期元素,它们的原子序数依次递增,Z原子的最外层电子数是次外层的3倍,只能有2个电子层,最外层电子数为6,则Z是O元素;X原子的电子层数与它的核外电子总数相等,且原子序数小于Z,所以X是H元素;Y和Z可以形成两种以上气态化合物,且Y原子序数小于Z,则Y为碳元素或氮元素,
A.Y和Z组成的N2O5中氮原子与氧元素质量之比为7:20,故A正确;
B.X为氢元素,Y为碳元素或氢元素,X与Y组成的化合物C2H6(或NH3)中X、Y原子数目之比为3:1,二者组成的C2H4(或N2H4)中X、Y原子数目之比为2:1,故B正确;
C.X、Y、Z可以组成,NH4NO3,其中X、Y、Z元素原子个数比为4:2:3,故C正确;
D.由H、N、O三种元素中的任意两种组成的具有10电子的微粒有H2O、OH-、NH3、NH4+,故D错误,
故选D.
A.Y和Z组成的N2O5中氮原子与氧元素质量之比为7:20,故A正确;
B.X为氢元素,Y为碳元素或氢元素,X与Y组成的化合物C2H6(或NH3)中X、Y原子数目之比为3:1,二者组成的C2H4(或N2H4)中X、Y原子数目之比为2:1,故B正确;
C.X、Y、Z可以组成,NH4NO3,其中X、Y、Z元素原子个数比为4:2:3,故C正确;
D.由H、N、O三种元素中的任意两种组成的具有10电子的微粒有H2O、OH-、NH3、NH4+,故D错误,
故选D.
点评:本题考查原子结构与元素化合物推断,难度不大,推断元素是解题关键,D选项中注意掌握常见10电子微粒,有利于基础知识的巩固.

练习册系列答案
 同步奥数系列答案
同步奥数系列答案
相关题目
臭氧的化学式是O3下列对臭氧的说法不正确的是( )
| A、它由氧元素组成 |
| B、它与氧分子互为同分异构体 |
| C、它是氧的同素异形体 |
| D、一个臭氧分子由3个氧原子构成 |
第二周期元素A和B能形成键角为180°的AB2气体分子,则下列推断不正确的是( )
| A、AB2分子的空间构型为直线形 |
| B、AB2分子为极性分子 |
| C、熔点、沸点:AB2<H2O |
| D、AB2与SiO2所属的晶体类型不相同 |
pH=13的 强碱与pH=1的强酸溶液等体积混合,所得混合液的pH值为( )
| A、>7 | B、<7 |
| C、=7 | D、无法确定 |
根据生活经验,判断下列物质按酸碱性的一定顺序依次排列正确的是( )
| A、厕所清洁剂 醋 肥皂 厨房清洁剂 |
| B、醋 厕所清洁剂 肥皂 厨房清洁剂 |
| C、厕所清洁剂 厨房清洁剂 醋 肥皂 |
| D、厨房清洁剂 醋 肥皂 厕所清洁剂 |

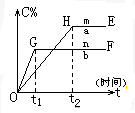 对于反应xA(g)+yB(g)?pC(g)+qD(g)压强与温度对C的质量分数的影响如图:
对于反应xA(g)+yB(g)?pC(g)+qD(g)压强与温度对C的质量分数的影响如图: