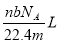题目内容
将1mol CH4和适量的氧气在密闭容器中点燃,充分反应后,甲烷和氧气均无剩余,且产物均为气体(101 kPa,120℃),其总质量为72 g,下列有关叙述不正确的是
A.产物的平均摩尔质量为24 g/mol
B.若将产物通过浓硫酸充分吸收后恢复至(101 kPa,120℃),则压强变为原来的1/3
C.反应中消耗的氧气为56 g
D.若将产物通过碱石灰,则可全被吸收,若通过浓硫酸,则不能被完全吸收
D
【解析】
试题分析:1mol CH4若完全燃烧产生1mol的CO2和2mol的H2O,其质量是80g,若燃烧产生1mol的CO和2mol的H2O,其质量是64g,现在混合物的质量是72 g,则含有CO、 CO2、H2O。A.根据元素守恒可知产物的物质的量是3mol,质量是72g,sy 平均摩尔质量为72g ÷3mol=24 g/mol,正确;B.若将产物通过浓硫酸充分吸收后恢复至(101 kPa,120℃),则水被吸收,由于气体的物质的量是原来的1/3,所以压强变为原来的1/3,正确;C.根据质量守恒定律可知反应中消耗的氧气为72g-16g=56 g,正确;D.若将产物通过碱石灰,由于其中含有CO,不能发生反应,所以不可全被吸收,若通过浓硫酸,由于只能吸收水,所以也不能被完全吸收,错误。
考点:考查CH4的燃烧产物的确定及实验操作的知识。

练习册系列答案
相关题目
 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体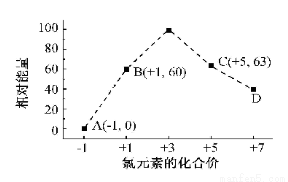


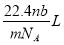 B.
B.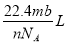 C
C 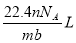 D.
D.