题目内容
(10分)元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)。
A.Cl2、Br2、I2的熔点 B. Cl2、Br2、I2的氧化性
C.HCl、HBr、HI的热稳定性 D. HCl、HBr、HI的酸性
(2)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体
①完成Ⅰ中反应的总化学方程式:□NaCl+□H2O=□NaClO3+□ 。
②Ⅱ中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其它晶体析出的原因是 。
(3)一定条件,在水溶液中1 mol Cl-、ClOX-(x=1,2,3,4)的能量(KJ)相对大小如右图所示。
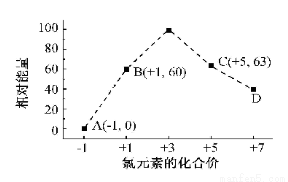
①D是 (填离子符号)。
②B→A+C反应的离子方程式为 ;生成1molC时, KJ的热(填吸收或放出以及具体数值)
(1)B、C (2分)
(2)①1NaCl+3H2O=1NaClO3+3H2↑ (2分)
②复分解反应 室温下,氯酸钾在水中的溶解度明显小于其它晶体(2分)
(3)①ClO4- (1分) ②3ClO-=ClO3- +2Cl-,(2分) 放出117(1分)
【解析】
试题分析:(1)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是元素形成的氢化物的稳定性会反应条件的难易,或产生的最高价氧化物对应的水化物的酸性强弱,或单质的氧化性的强弱。乙醇选项是B、C。(2)①反应Ⅰ是氧化还原反应,根据电子守恒、原子守恒可知:Ⅰ中反应的总化学方程式:1NaCl+3H2O=1NaClO3+3H2↑;②Ⅱ中元素的化合价没有发生变化,所以转化的基本反应类型是复分解反应;该反应过程能析出KClO3晶体而无其它晶体析出的原因是室温下,氯酸钾在水中的溶解度明显小于其它晶体;(3)①根据物质中元素的化合价的变化规律可知D是ClO4- ;②B→A+C反应是歧化反应,根据元素守恒、原子守恒、电荷守恒可得:该反应的离子方程式为3ClO-=ClO3- +2Cl-,由方程式可知每产生1mol的C会消耗3mol的B,同时产生2mol的Cl-,能量变化是ΔH=-3×60KJ+2×O+63KJ =-117KJ,即发出热量117KJ.
考点:考查元素非金属性强弱的比较依据、离子方程式和化学方程式的书写、物质反应过程中的能量变化。


 3Y+Z
3Y+Z 