题目内容
6.下列两种气体的分子数一定相等的是( )| A. | 质量相等的O2和O3 | B. | 原子数目相等的CO和N2 | ||
| C. | 电子数目相等的O2和N2 | D. | 等压、等体积的N2和CH4 |
分析 由pV=nRT可知,p、T相同时Vm相同,由N=nNA可知,n相同时,分子数一定相同,以此来解答.
解答 解:A.M不同,m相同时,由n=$\frac{m}{M}$可知,n不相同,故A不选;
B.原子数目相等的CO和N2,分子的物质的量相同,则分子数相同,故B选;
C.O2和N2的电子数分别为16、14,电子数目相等的O2和N2,气体的物质的量不同,故C不选;
D.温度未知,Vm不确定,气体的物质的量可能不同,故D不选;
故选B.
点评 本题考查阿伏伽德罗定律及应用,为高频考点,把握气体物质的量的确定为解答的关键,侧重分析与计算能力的考查,注意分子的构成,题目难度不大.

练习册系列答案
相关题目
10.下列过程中吸收热量的是( )
| A. | 焦炭制水煤气 | B. | 浓硫酸的稀释 | C. | 酸碱中和反应 | D. | 镁条溶于盐酸 |
11.有机物甲、乙的结构如图所示,下列说法正确的是( )
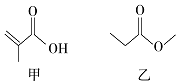
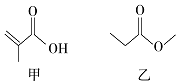
| A. | 甲、乙互为同分异构体 | |
| B. | 甲、乙都能发生取代、加成反应 | |
| C. | 与甲具有相同官能团的同分异构体还有2种 | |
| D. | 与乙具有相同官能团的同分异构体还有2种 |
8.4-AFMF是一种探测物质的荧光素,其结构简式如图.下列有关该物质的说法正确的是( )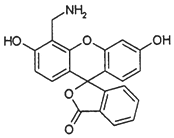

| A. | 分子中三个苯环处于同一平面 | |
| B. | 1 mol 4-AFMF 最多可与2molNaOH 反应 | |
| C. | 在酸性条件下水解,水解产物只有1种 | |
| D. | 能与溴水、FeCl3溶液及稀硫酸发生反应 |
1.为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿(CHCl3).CCl4+H2?CHCl3+HCl△H=QKJ•mol-1.已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据(不考虑副反应)
(1)110℃时平衡常数1
(2)实验1中,CCl4的转化率A为60%,平衡时c(CHCl3)=0.48mol/L
(3)实验2中,10小时后达到平衡,H2的平均反应速率为0.05mol/(L•h)
在此实验的平衡体系中,再加入1.0molCCl4和0.5molHCl,平衡将向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”);
(4)实验3中,B的值②
①等于50% ②大于50% ③小于50% ④无法判断
(5)能判断该反应已达到化学平衡状态的依据是BC
A.容器中压强不变
B.反应热△H不变
C.v正(H2)=v逆(HCl)
D.混合气体的密度保持不变.
| 实验序号 | 温度℃ | 初始CCl4浓度mol/L | 初始H2浓度mol/L | CCl4的平衡转化率 |
| 1 | 110 | 0.8 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 120 | 1 | 1 | B |
(2)实验1中,CCl4的转化率A为60%,平衡时c(CHCl3)=0.48mol/L
(3)实验2中,10小时后达到平衡,H2的平均反应速率为0.05mol/(L•h)
在此实验的平衡体系中,再加入1.0molCCl4和0.5molHCl,平衡将向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”);
(4)实验3中,B的值②
①等于50% ②大于50% ③小于50% ④无法判断
(5)能判断该反应已达到化学平衡状态的依据是BC
A.容器中压强不变
B.反应热△H不变
C.v正(H2)=v逆(HCl)
D.混合气体的密度保持不变.
11.等物物的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g)?2Z(g)+W(s)△H<0,下列叙述正确的是( )
| A. | 达到平衡后再充入少量X气体,上述反应的△H增大 | |
| B. | 达到平衡时,反应速率v正(X)=2v逆(Z) | |
| C. | 达到平衡后,降低温度,正向反应速率大于逆向反应速率 | |
| D. | 达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动 |
18.下列离子方程式正确的是( )
| A. | 氯化铁溶液中加入足量的氨水:Fe3++3OH-═Fe(OH)3↓ | |
| B. | 铁片与稀硝酸反应Fe+2H+═Fe2++H2↑ | |
| C. | 氯气通入氯化亚铁溶液:Cl2+Fe2+═2Cl-+Fe3+ | |
| D. | 氢氧化铝溶于氢氧化钠溶液:Al(OH)3+OH-═AlO2-+2H2O |
15.工业上通常采用N2(g)和H2(g)崔华成NH3(g):N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
(1)在一定温度下,若将10amolN2和30amolH2放入2L的密闭容器中,充分反应后测得平衡时N2的转化率为60%,则该反应的平衡常数为$\frac{1}{12{a}^{2}}$(用含a的代数式表示).若此时再向该容器中投入10amolN2、20amolH2和20amolNH3,判断平衡移动的方向是正向移动(填“正向移动”“逆向移动”或“不移动”).
(2)若反应起始时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L.则NH3达到平衡时浓度的范围为0mol/L<c(NH3)<0.3mol/L;若平衡时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L,则NH3起始时浓度的范围为0mol/L≤c(NH3)≤0.3mol/L.
(3)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
则Q1+Q2=92.4kJ;a1+a2=l(填“<”“>”或“=”•下同):2p2>p3
(4)如图:A是恒容的密闭容器,B是一个体积可变的充气气囊.保持恒温,关闭K2,将1molN2和3molH2通过K3充入B中,将2molN2和6molH2通过K1充入A中;起始时A、B的体积相同均为1L,达到平衡时,V(B)=0.9L;然后打开K2,一段时间又达到平衡时,B的体积为1.7L(连通管中气体体积不计).

(1)在一定温度下,若将10amolN2和30amolH2放入2L的密闭容器中,充分反应后测得平衡时N2的转化率为60%,则该反应的平衡常数为$\frac{1}{12{a}^{2}}$(用含a的代数式表示).若此时再向该容器中投入10amolN2、20amolH2和20amolNH3,判断平衡移动的方向是正向移动(填“正向移动”“逆向移动”或“不移动”).
(2)若反应起始时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L.则NH3达到平衡时浓度的范围为0mol/L<c(NH3)<0.3mol/L;若平衡时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L,则NH3起始时浓度的范围为0mol/L≤c(NH3)≤0.3mol/L.
(3)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 | |
| 平衡时数据 | 反应能量变化的绝对值(kJ) | Q1 | Q2 | Q3 |
| 反应物转化率 | a1 | a2 | a3 | |
| 体系压强(Pa) | p1 | P2 | P3 | |
(4)如图:A是恒容的密闭容器,B是一个体积可变的充气气囊.保持恒温,关闭K2,将1molN2和3molH2通过K3充入B中,将2molN2和6molH2通过K1充入A中;起始时A、B的体积相同均为1L,达到平衡时,V(B)=0.9L;然后打开K2,一段时间又达到平衡时,B的体积为1.7L(连通管中气体体积不计).

16.设NA为阿伏伽德罗常数的值.已知乙烯和环丙烷(C3H6)组成的混合气体的质量为28g,下列对该混合气体的说法错误的是( )
| A. | 混合气体中含有的碳碳双键数为NA | |
| B. | 混合气体中含有的碳原子数为2NA | |
| C. | 当混合气体完全燃烧时,消耗O2的分子数为3NA | |
| D. | 当混合气体完全燃烧时,转移的电子数为12NA |