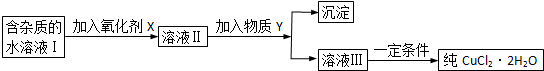
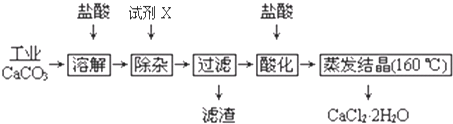
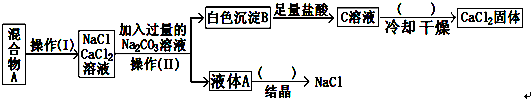
题目内容
请结合所学知识设计实验,证实AlO2-结合H+的能力比CO32-强,供选试剂:NaOH溶液、AlCl3溶液、CuSO4溶液、pH试纸、NaHCO3溶液、FeCl3溶液(仪器自选).
①操作要点 ;
②能证明AlO2-结合H+的能力强于CO32-的反应的离子方程式: .
①操作要点
②能证明AlO2-结合H+的能力强于CO32-的反应的离子方程式:
考点:性质实验方案的设计
专题:实验设计题
分析:证实AlO2-结合H+的能力比CO32-强,可利用NaOH溶液、AlCl3溶液得到偏铝酸钠溶液,向偏铝酸钠溶液中加NaHCO3溶液,若生成沉淀,则AlO2-结合H+的能力比CO32-强,以此来解答.
解答:
解:证实AlO2-结合H+的能力比CO32-强,可设计实验发生证实AlO2-促进HCO3-的电离,生成氢氧化铝沉淀和碳酸根离子,则
①操作要点为:a:取少量的AlCl3溶液于试管中,b:向试管中逐滴加入NaOH溶液直至产生白色沉淀恰好全部消失,c:向其中再滴入NaHCO3溶液至足量;
②证明AlO2-结合H+的能力强于CO32-的反应的离子方程式为AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-,
故答案为:a:取少量的AlCl3溶液于试管中,b:向试管中逐滴加入NaOH溶液直至产生白色沉淀恰好全部消失,c:向其中再滴入NaHCO3溶液至足量;AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-.
①操作要点为:a:取少量的AlCl3溶液于试管中,b:向试管中逐滴加入NaOH溶液直至产生白色沉淀恰好全部消失,c:向其中再滴入NaHCO3溶液至足量;
②证明AlO2-结合H+的能力强于CO32-的反应的离子方程式为AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-,
故答案为:a:取少量的AlCl3溶液于试管中,b:向试管中逐滴加入NaOH溶液直至产生白色沉淀恰好全部消失,c:向其中再滴入NaHCO3溶液至足量;AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-.
点评:本题考查性质实验方案的设计,为高频考点,把握偏铝酸钠溶液与NaHCO3溶液发生的反应、AlO2-促进HCO3-的电离等为解答的关键,侧重分析与实验设计能力的考查,题目难度不大.

练习册系列答案
相关题目
下列表示物质结构的化学用语正确的是( )
| A、乙烯的结构简式:CH2CH2 |
B、NaCl的电子式: |
C、镁离子的结构示意图: |
D、CH4的比例模型: |
在一定条件下,下列物质不能发生消去反应的是( )
| A、C2H5OH |
| B、(CH3)2CHCl |
| C、(CH3)3CCl |
| D、(CH3)3CCH2Cl |
大量事实证明,水溶液中并不存在H+、AlO2-等离子,实际存在的是H30+、[Al(OH)4]-.铝和强碱溶液的反应可以理解为铝在碱性环境下先与水反应,而后进一步与强碱反应(反应均不可逆).对于Al与重氢氧化钠(NaOD)的水溶液反应(假定水中不含氘和氚),下列说法正确的是( )
| A、生成的氢气中只含有D2 |
| B、生成的氢气中只含有H2 |
| C、生成的氢气中含有H2、HD、D2 |
| D、以上判断都不正确 |
如图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( )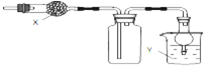

| A、X是碱石灰,收集到的气体是氯化氢,Y是水 |
| B、X是碱石灰,收集到的气体是氨气,Y是水 |
| C、X是氯化钙,搜集到的气体是二氧化硫,Y是氢氧化钠 |
| D、X是氯化钙,收集到的气体是一氧化氮,Y是氢氧化钠 |
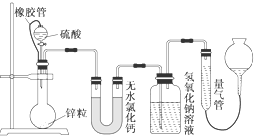 不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气.某校研究性学习小组拟设计实验验证这一事实,并进行数据测定和相关计算.
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气.某校研究性学习小组拟设计实验验证这一事实,并进行数据测定和相关计算.