题目内容
19.下列实验方案不合理的是( )| A. | 用KSCN溶液检验FeCl2是否已被氧化而变质 | |
| B. | 用焰色反应鉴别NaCl和KCl | |
| C. | 用加热法除去Na2CO3中混有的NaHCO3杂质 | |
| D. | 用NaOH溶液除去MgCl2溶液中的CuCl2杂质 |
分析 A.Fe3+与KSCN反应,溶液变为红色;
B.钠和钾的焰色反应现象不同;
C.碳酸氢钠不稳定,加热易分解;
D.二者都与氢氧化钠溶液反应.
解答 解:A.如FeCl2变质,被氧化为Fe3+,Fe3+与KSCN反应,溶液变为红色,可检验,故A正确;
B.钠和钾的焰色反应现象不同,可用焰色反应鉴别,故B正确;
C.碳酸氢钠不稳定,加热易分解,可生成碳酸钠,故C正确;
D.二者都与氢氧化钠溶液反应,可加入镁除杂,故D错误.
故选D.
点评 本题考查了实验方案评价,明确实验原理是解本题关键,结合物质的性质来分析解答,知道常见离子的检验方法、物质的鉴别等知识点即可解答,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.下列过程只涉及物理变化的是( )
| A. | 臭氧消毒 | B. | 丹桂飘香 | C. | 牛奶变酸 | D. | 食醋除锈 |
14.下列关于金属铝的叙述正确的是( )
| A. | 能与NaOH溶液反应放出H2 | B. | 不能与硫酸铜溶液反应 | ||
| C. | 在常温下不能与O2反应 | D. | 遇冷浓硫酸不发生 |
11.常温下,下列气体为无色的是( )
| A. | NO2 | B. | ClO2 | C. | Cl2 | D. | SO2 |
8.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 0.5mol?L-1K2SO4含有的K+数目为NA | |
| B. | 56g铁与足量的盐酸反应时失去电子的数目为3NA | |
| C. | 在标准状况下,22.4LCCl4中含有的分子数目为NA | |
| D. | 在常温常压下,16gO2和O3的混合气体所含原子数目为NA |
 某温度下,固体溶质之溶解度曲线如右图,试依据此图回答下列问题:
某温度下,固体溶质之溶解度曲线如右图,试依据此图回答下列问题:

 分别表示N2、H2、NH3):
分别表示N2、H2、NH3):
 的量之比(氨碳比)$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=x,如图是CO2平衡转化率(α) 与氨碳比(x)的关系.
的量之比(氨碳比)$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=x,如图是CO2平衡转化率(α) 与氨碳比(x)的关系.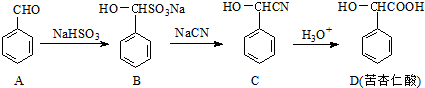
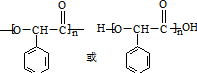
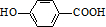 .
.


