题目内容
11.在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反应中( )| A. | 氧化产物与还原产物粒子个数比是2:5 | |
| B. | 被氧化的盐酸占参加反应盐酸总数的$\frac{5}{8}$ | |
| C. | KMnO4只有一部分发生还原反应 | |
| D. | KMnO4与HCl恰好分别完全发生还原反应和氧化反应 |
分析 在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反应中,Mn元素化合价降低,被还原,Cl元素化合价升高,被氧化,KMnO4为氧化剂,HCl为还原剂,结合化合价的变化解答该题.
解答 解:在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反应中,Mn元素化合价降低,被还原,Cl元素化合价升高,被氧化,KMnO4为氧化剂,HCl为还原剂,Cl2为氧化产物,MnCl2为还原产物,当有2molKMnO4参加反应时,有10molHCl被氧化,
A、氧化产物与还原产物的物质的量之比为5:2,故A错误;
B、当有2molKMnO4参加反应时,有10molHCl被氧化,所以被氧化的盐酸占参加反应盐酸总分子数的$\frac{5}{8}$,故B正确;
C、2molKMnO4全部发生还原反应,故C错误;
D、当有2molKMnO4参加反应时,有10molHCl被氧化,所以HCl没有分别完全发生氧化反应,故D错误;
故选B.
点评 本题考查氧化还原反应,题目难度不大,注意根据元素化合价的变化结合反应的化学方程式的计量数进行判断.

练习册系列答案
相关题目
1.下列叙述正确的是( )
| A. | 钠的金属活泼性大于铜,在溶液中钠可以置换出铜 | |
| B. | 在稀硫酸中加入铜粉,铜粉不溶解,再加入KNO3固体,铜粉仍不溶解 | |
| C. | 在KI溶液中加入NaNO3,没有明显现象,加入盐酸,即有I2生成 | |
| D. | 纯锌与稀硫酸反应产生氢气的速率较,加入少量CuSO4固体,速率不改变 |
2.将铜丝放在酒精灯上加热片刻后,立即浸入乙醇中,反复多次可观察到的现象是( )
| A. | 铜丝在乙醇中变黑 | B. | 铜丝点燃后变红 | ||
| C. | 反应中产生黑烟 | D. | 铜丝在乙醇中变红 |
19.已知:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.向含1mol NaOH、0.5mol Ba(OH)2、1mol NaAlO2的混合液中缓慢通入CO2,则通入CO2的量和生成沉淀的量的关系不正确的是( )
| 选项 | A | B | C | D |
| n(CO2)(mol) | 1 | 1.5 | 2 | 3 |
| n(沉淀)(mol) | 0.5 | 1 | 1.5 | 1 |
| A. | A | B. | B | C. | C | D. | D |
6.对于反应A(g)+3B(g)?2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是( )
| A. | v(A)=0.01 mol/(L•s) | B. | v(B)=0.02 mol/(L•s) | C. | v(B)=0.60mol/(L•s) | D. | v(C)=0.5mol/(L•s) |
20.已知Br2跟NaOH溶液的反应类似于Cl2跟NaOH溶液的反应.用溴水作试剂可以将下列各选项中的溶液鉴别出来的是( )
| A. | 水、汽油、酒精 | B. | AgNO3、NaOH、KI | C. | NaCl、NaBr、NaI | D. | 汽油、酒精、NaOH |
1.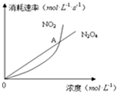 在80℃时,将0.40mol 的N2O4气体充入2L 已经抽成真空的固定容积的密闭容器中,发生如下反应:N2O4(g)?2NO2(g)△H=+56.9kJ/mol,隔一段时间对该容器内的物质进行分析,得到如下数据:
在80℃时,将0.40mol 的N2O4气体充入2L 已经抽成真空的固定容积的密闭容器中,发生如下反应:N2O4(g)?2NO2(g)△H=+56.9kJ/mol,隔一段时间对该容器内的物质进行分析,得到如下数据:
(1)计算在80℃时该反应的平衡常数K=1.8.
(2)反应进行至100s 后将反应混合物的温度降低,混合气体的颜色变浅(填“变浅”、“变深”或“不变”).
(3)要增大该反应的K值,可采取的措施有D(填序号).
A.增大N2O4起始浓度 B.向混合气体中通入NO2C.使用高效催化剂 D.升高温度
(4)当反应达到平衡后,下列操作,不能使平衡混合气体颜色加深的是D
A.恒温恒容下再通入N2O4气体
B.恒温恒容下再通入NO2气体
C.恒容时,升高温度
D.恒温恒容时通入Ar
E.恒温时压缩体积
(5)图中,交点A表示该反应的所处的状态为B
A.平衡状态 B.朝正反应方向移动C.朝逆反应方向移动 D.无法判断.
 在80℃时,将0.40mol 的N2O4气体充入2L 已经抽成真空的固定容积的密闭容器中,发生如下反应:N2O4(g)?2NO2(g)△H=+56.9kJ/mol,隔一段时间对该容器内的物质进行分析,得到如下数据:
在80℃时,将0.40mol 的N2O4气体充入2L 已经抽成真空的固定容积的密闭容器中,发生如下反应:N2O4(g)?2NO2(g)△H=+56.9kJ/mol,隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(2)反应进行至100s 后将反应混合物的温度降低,混合气体的颜色变浅(填“变浅”、“变深”或“不变”).
(3)要增大该反应的K值,可采取的措施有D(填序号).
A.增大N2O4起始浓度 B.向混合气体中通入NO2C.使用高效催化剂 D.升高温度
(4)当反应达到平衡后,下列操作,不能使平衡混合气体颜色加深的是D
A.恒温恒容下再通入N2O4气体
B.恒温恒容下再通入NO2气体
C.恒容时,升高温度
D.恒温恒容时通入Ar
E.恒温时压缩体积
(5)图中,交点A表示该反应的所处的状态为B
A.平衡状态 B.朝正反应方向移动C.朝逆反应方向移动 D.无法判断.


 ,第一电离能最小的元素的原子轨道表达式
,第一电离能最小的元素的原子轨道表达式 .
.