题目内容
1.下列叙述正确的是( )| A. | 钠的金属活泼性大于铜,在溶液中钠可以置换出铜 | |
| B. | 在稀硫酸中加入铜粉,铜粉不溶解,再加入KNO3固体,铜粉仍不溶解 | |
| C. | 在KI溶液中加入NaNO3,没有明显现象,加入盐酸,即有I2生成 | |
| D. | 纯锌与稀硫酸反应产生氢气的速率较,加入少量CuSO4固体,速率不改变 |
分析 A、根据钠与盐溶液反应时,先与水反应,然后生成的碱再与盐反应;
B、根据铜的化学性质,如:铜不能与非氧化性酸反应,但可以和氧化性酸反应,酸性条件下硝酸盐反应;
C、碘离子具有还原性,加入硝酸钠不反应,加入盐酸形成稀硝酸具有氧化性,氧化碘离子为单质碘;
D、锌和铜在酸性条件下形成原电池反应,反应速率较大.
解答 解:A、钠与盐溶液反应时,先与水反应,然后生成的碱再与盐反应,所以Na不能从铜盐溶液中置换出Cu,故A错误;
B、根据铜与稀HNO3反应,由该反应的离子方程式:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,可知Cu遇到H+、NO3-能发生氧化还原反应,故B错误;
C、碘离子具有还原性,加入硝酸钠不反应,加入盐酸形成稀硝酸具有氧化性,在KI溶液中加入NaNO3,没有明显现象,加入盐酸,即有I2生成,故C正确;
D、加入少量CuSO4固体,置换出铜,锌和铜在酸性条件下形成原电池反应,反应速率较大,故D错误;
故选C.
点评 本题考查了物质性质的分析判断,主要是氧化还原反应发生的条件和产物判断,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
18.CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示.下列说法正确的是( )
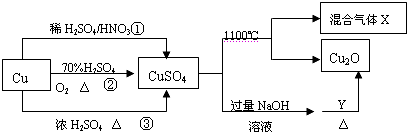

| A. | 1mol CuSO4在1100℃所得混合气体X中O2可能为0.75mol(X的组成为SO2、SO3、O2) | |
| B. | 相对于途径①、②,途径③更好地体现了绿色化学理念 | |
| C. | 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2 | |
| D. | Y一定是葡萄糖 |
16.下表列出了A~R十二种元素在周期表中的位置:
请用相应的化学符号和化学用语回答下列问题:
(1)其中化学性质最不活泼的是Ar,最活泼的金属元素是K;
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是NaOH;其中J与F按原子个数1:1所成的化合物的电子式为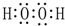 .
.
(3)A、B、C三种元素按离子半径由大到小的顺序排列为K+>Na+>Mg2+;
(4)E和J形成原子个数比为1:3化合物的结构简式CH3CH3,该物质与G的单质在一定条件下发生取代反应生成的二取代产物有2种.
(5)元素G的气态氢化物比元素H的气态氢化物稳定(填“稳定”或“不稳定”).元素K和I的气态氢化物沸点较高的是NH3(填化学式).其原因是氨气分子之间存在氢键.
(6)元素G的单质溶于元素A的最高价氧化物对应的水化物中,可生成具有漂白作用的一种盐,该盐的化学式为NaClO,该化合物中所含的化学键类型为_离子键、共价键.
(7)元素B、C、D的简单阳离子的氧化性比较Al3+>Mg2+>Na+.(填离子符号)
(8)1g元素J的单质完全燃烧生成液态氧化物时放出的热量为142.9KJ,写出元素J的单质燃烧热的热化学方程式:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1 .
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | J | |||||||
| 2 | E | K | F | |||||
| 3 | A | C | D | I | G | R | ||
| 4 | B | H |
(1)其中化学性质最不活泼的是Ar,最活泼的金属元素是K;
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是NaOH;其中J与F按原子个数1:1所成的化合物的电子式为
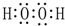 .
.(3)A、B、C三种元素按离子半径由大到小的顺序排列为K+>Na+>Mg2+;
(4)E和J形成原子个数比为1:3化合物的结构简式CH3CH3,该物质与G的单质在一定条件下发生取代反应生成的二取代产物有2种.
(5)元素G的气态氢化物比元素H的气态氢化物稳定(填“稳定”或“不稳定”).元素K和I的气态氢化物沸点较高的是NH3(填化学式).其原因是氨气分子之间存在氢键.
(6)元素G的单质溶于元素A的最高价氧化物对应的水化物中,可生成具有漂白作用的一种盐,该盐的化学式为NaClO,该化合物中所含的化学键类型为_离子键、共价键.
(7)元素B、C、D的简单阳离子的氧化性比较Al3+>Mg2+>Na+.(填离子符号)
(8)1g元素J的单质完全燃烧生成液态氧化物时放出的热量为142.9KJ,写出元素J的单质燃烧热的热化学方程式:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1 .
6.已知450℃时,2SO2(g)+O2(g)?2SO3(g)△H=-Q1,在相同条件下,向一密闭容器中通入1molSO2和0.5molO2,达到平衡时放出的热量为Q2,则Q1、Q2满足的关系是( )
| A. | Q2<$\frac{{Q}_{1}}{2}$ | B. | Q2>$\frac{{Q}_{1}}{2}$ | C. | Q2=$\frac{{Q}_{1}}{2}$ | D. | 不能确定 |
13.有人认为在元素周期表中,位于ⅠA族的氢元素,也可放ⅦA族,下列能支持这一观点的是( )
| A. | HF | B. | NaH | C. | H3O+ | D. | NH4Cl |
11.在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反应中( )
| A. | 氧化产物与还原产物粒子个数比是2:5 | |
| B. | 被氧化的盐酸占参加反应盐酸总数的$\frac{5}{8}$ | |
| C. | KMnO4只有一部分发生还原反应 | |
| D. | KMnO4与HCl恰好分别完全发生还原反应和氧化反应 |
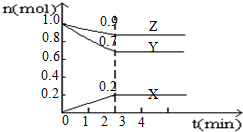 某温度时,在4L的容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在4L的容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.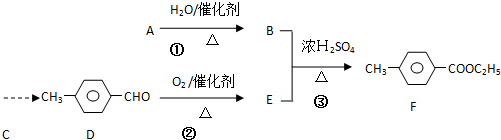
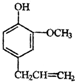 )是一种重要的调味剂,它与F的关系是b(填序号).
)是一种重要的调味剂,它与F的关系是b(填序号).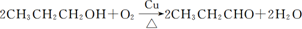 ,氧化反应;
,氧化反应;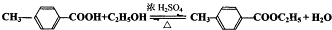 ,取代反应(或酯化反应).
,取代反应(或酯化反应).