题目内容
19.已知:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.向含1mol NaOH、0.5mol Ba(OH)2、1mol NaAlO2的混合液中缓慢通入CO2,则通入CO2的量和生成沉淀的量的关系不正确的是( )| 选项 | A | B | C | D |
| n(CO2)(mol) | 1 | 1.5 | 2 | 3 |
| n(沉淀)(mol) | 0.5 | 1 | 1.5 | 1 |
| A. | A | B. | B | C. | C | D. | D |
分析 CO2通入到NaOH、Ba(OH)2、NaAlO2的混合溶液,反应的先后顺序为:Ba(OH)2、NaOH、NaAlO2,含有NaOH、Ba(OH)2、NaAlO2的混合溶液中慢慢通入CO2,发生的反应有:CO2+Ba(OH)2=BaCO3↓+H2O;2NaOH+CO2=Na2CO3+H3O;2NaAlO2+3H2O+CO2=2Al(OH)3↓+Na2CO3;若二氧化碳过量,还发生Na2CO3+CO2+H2O=2NaHCO3 ,BaCO3+CO2+H2O=Ba(HCO3)2,根据反应的方程式计算.
解答 解:A.通入1mol二氧化碳,先发生反应:Ba(OH)2+CO2=BaCO3↓+H2O,消耗0.5mol二氧化碳,生成0.5mol碳酸钡沉淀,剩余的0.5mol二氧化碳与1mol氢氧化钠反应恰好反应,CO2+2NaOH=Na2CO3+H2O,则沉淀只有0.5mol,故A不选;
B.通入1.5mol二氧化碳,先发生反应:Ba(OH)2+CO2=BaCO3↓+H2O,消耗0.5mol二氧化碳,生成0.5mol碳酸钡沉淀,后0.5mol二氧化碳与1mol氢氧化钠反应恰好反应,CO2+2NaOH=Na2CO3+H2O,剩余的0.5mol与1mol NaAlO2刚好完全反应,2NaAlO2+3H2O+CO2=2Al(OH)3↓+Na2CO3,所以沉淀有0.5mol碳酸钡和1mol的氢氧化铝共1.5mol,故B选;
C.通入2mol二氧化碳,先发生反应:Ba(OH)2+CO2=BaCO3↓+H2O,消耗0.5mol二氧化碳,生成0.5mol碳酸钡沉淀,后0.5mol二氧化碳与1mol氢氧化钠反应恰好反应,CO2+2NaOH=Na2CO3+H2O,再用0.5mol与1mol NaAlO2刚好完全反应,2NaAlO2+3H2O+CO2=2Al(OH)3↓+Na2CO3,最后剩余0.5mol发生Na2CO3+CO2+H2O=2NaHCO3 ,故生成沉淀总物质的量为1.5mol,故C不选;
D.通入3mol二氧化碳,先发生反应:Ba(OH)2+CO2=BaCO3↓+H2O,消耗0.5mol二氧化碳,生成0.5mol碳酸钡沉淀,后0.5mol二氧化碳与1mol氢氧化钠反应恰好反应,CO2+2NaOH=Na2CO3+H2O,再用0.5mol与1mol NaAlO2刚好完全反应,2NaAlO2+3H2O+CO2=2Al(OH)3↓+Na2CO3,最后剩余1.5mol发生Na2CO3+CO2+H2O=2NaHCO3 ,BaCO3+CO2+H2O=Ba(HCO3)2,故生成沉淀总物质的量为1mol,故D不选;
故选:B.
点评 本题考查了化学方程式的相关计算,题目难度中等,把握反应的先后顺序是解题的关键,注意二氧化碳与碱反应量的关系对反应的影响.

 阅读快车系列答案
阅读快车系列答案| A. | v(A)=0.01mol/(L•S) | B. | v(B)=0.02mol/(L•S) | C. | v(B)=0.60mol/(L•S) | D. | v(C)=1.0mol/(L•S) |
| A. | 氧化产物与还原产物粒子个数比是2:5 | |
| B. | 被氧化的盐酸占参加反应盐酸总数的$\frac{5}{8}$ | |
| C. | KMnO4只有一部分发生还原反应 | |
| D. | KMnO4与HCl恰好分别完全发生还原反应和氧化反应 |
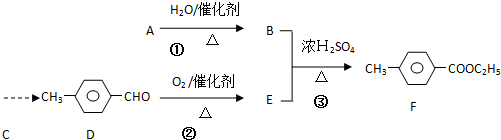
 )是一种重要的调味剂,它与F的关系是b(填序号).
)是一种重要的调味剂,它与F的关系是b(填序号). ,氧化反应;
,氧化反应;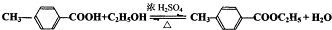 ,取代反应(或酯化反应).
,取代反应(或酯化反应). (1)写出制取乙酸乙酯的化学反应方程式CH3COOH+CH3CH2OH
(1)写出制取乙酸乙酯的化学反应方程式CH3COOH+CH3CH2OH CH3COOC2H5+H2O;
CH3COOC2H5+H2O;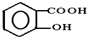 ,请回答下列问题:
,请回答下列问题: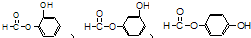 ;
;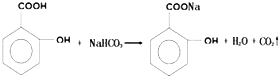
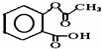 ,1摩尔阿司匹林与NaOH完全反应需要氢氧化钠3mol.
,1摩尔阿司匹林与NaOH完全反应需要氢氧化钠3mol.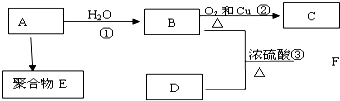
 ;
; 科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空.如下图所示装置中,以稀土金属材料作惰性电极,在两极上分别通入丙烷和空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传导正极生成的O2-.
科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空.如下图所示装置中,以稀土金属材料作惰性电极,在两极上分别通入丙烷和空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传导正极生成的O2-.