题目内容
15.常温下将0.15mol/L稀硫酸V1 mL与0.1mol/L NaOH溶液V2 mL混合,所得溶液的pH为1,则V1:V2=1:1(溶液体积变化忽略不计).分析 所得溶液的pH值为1,溶液中氢离子浓度为1×10-1mol•L-1,说明氢离子过量,根据题中稀硫酸和氢氧化钠溶液体积列式计算出V1:V2的比值.
解答 解:溶液中氢氧化钠的物质的量为:V2×10-3L×0.1mol/L=V2×10-4mol,
稀硫酸的物质的量为:V1×10-3L×0.15mol/L×2=3V1×10-4mol,
两溶液混合后溶液显示酸性,常温下pH=1的溶液中氢离子浓度为1×10-1mol•L-1,
则:3V1×10-4mol-V2×10-4mol=(V1+V2)×10-3L×1×10-1mol•L-1=(V1+V2)×10-4mol,
解得:V1:V2=1:1,
故答案为:1:1.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度不大,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握溶液pH的概念及表达式,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
5.将二氧化碳通入到下列溶液中,不能发生反应的是( )
| A. | CaCl2 | B. | Na2CO3 | C. | Na2SiO3 | D. | NaOH |
20.关于炼铁原理下列说法正确的是( )
| A. | 铁矿石在高温下被氧化成铁 | B. | 生铁中杂质被氧化 | ||
| C. | 铁矿石在高温下被焦炭还原成铁 | D. | 铁矿石在高温下被CO还原成铁 |
7.氮化硼是一种新合成的结构材料,它是一种超硬、耐磨、耐高温的物质.下列各组物质熔化时所克服的微粒间的作用力与氮化硼熔化时所克服的微粒间的作用力都相同的是( )
| A. | 硝酸钠和金刚石 | B. | 晶体硅和水晶(SiO2) | ||
| C. | 水晶(SiO2)和干冰 | D. | NaCl和 I2 |
4.检验二氧化硫气体中是否混有二氧化碳气体,可采用的方法是( )
| A. | 通过品红溶液 | |
| B. | 先通过氢氧化钠溶液,再通过澄清石灰水 | |
| C. | 先通过饱和碳酸氢钠溶液,再通过澄清石灰水 | |
| D. | 先通过酸性高锰酸钾溶液,再通过澄清石灰水 |
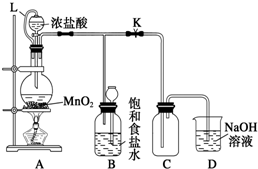
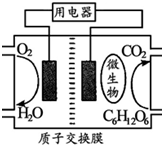 Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.