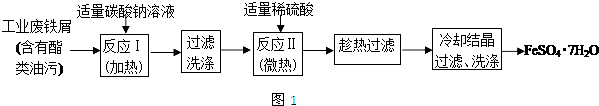
题目内容
5.某实验小组模拟工业上用SiHCl3与H2在1357 K的条件下制备高纯硅,实验装置如下图所示 (加热及夹持装置略去):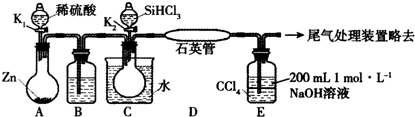
已知SiHCl3的性质如下:沸点为33.0℃;密度为1.34 g•mL-1;易溶于有机溶剂;能与H2O剧烈反应;在空气中易被氧化.请回答:
(1)装置C中的烧瓶用水浴加热的优点为受热均匀,得到平稳的SiHCl3气流
(2)装置D中发生反应的化学方程式为SiHCl3+H2$\frac{\underline{\;1357K\;}}{\;}$Si+3HCl
(3)装置E的作用为四氯化碳吸收未反应的SiHCl3、氢氧化钠溶液吸收HCl、防止倒吸.
(4)相关实验步骤如下,其合理顺序为②⑤①④③(填序号).
①加热装置C,打开K2,滴加6.5 mL SiHCl3;
②打开K1,装置A中反应一段时间;
③关闭K1;
④关闭K2;
⑤加热装置D至1357K.
(5)计算SiHCl3的利用率:对装置E中液体进行分液操作,取上层液体20.00 mL转移至锥形瓶中,滴加几滴酚酞溶液.用0.1 mol•L-1盐 酸滴定,达到滴定终点时,消耗盐酸20.00 mL.达到滴定终点的现象是溶液红色褪去,且半分钟不变色.SiHCl3的利用率为93.34%(保留两位小数).
(6)设计实验,检验SiHCl3与水反应后,所得溶液中存在盐酸取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸.
分析 A装置制备氢气,B装置中盛放浓硫酸干燥氢气,防止SiHCl3水解,利用生成的氢气排尽装置内空气,防止安全事故的发生,再在D中反应得到高纯硅,同时生成HCl气体,D装置中四氯化碳吸收未反应的SiHCl3,氢氧化钠溶液吸收HCl,还可以防止倒吸,最后可以利用燃烧法处理氢气.
(1)受热均匀,得到平稳的SiHCl3气流;
(2)D中氢气与SiHCl3反应生成Si与HCl;
(3)吸收SiHCl3及HCl,并防止倒吸;
(4)先通入氢气,排尽装置中空气,再加热石英管,提高原理利用率,反应完毕停止通氢气;
(5)滴定终点时,氢氧化钠完全反应,溶液红色褪去;
氢氧化钠物质的量等于生成的HCl与后加入HCl的物质的量之和,可以计算生成HCl的物质的量,再根据方程式计算参加反应SiHCl3的质量,进而计算其利用率;
(6)检验溶液中含有H+、Cl-可以证明生成HCl.
解答 解:A装置制备氢气,B装置中盛放浓硫酸干燥氢气,防止SiHCl3水解,利用生成的氢气排尽装置内空气,防止安全事故的发生,再在D中反应得到高纯硅,同时生成HCl气体,D装置中四氯化碳吸收未反应的SiHCl3,氢氧化钠溶液吸收HCl,还可以防止倒吸,最后可以利用燃烧法处理氢气.
(1)水浴加热,受热均匀,得到平稳的SiHCl3气流,
故答案为:受热均匀,得到平稳的SiHCl3气流;
(2)D中氢气与SiHCl3反应生成Si与HCl,反应方程式为:SiHCl3+H2$\frac{\underline{\;1357K\;}}{\;}$Si+3HCl,
故答案为:SiHCl3+H2$\frac{\underline{\;1357K\;}}{\;}$Si+3HCl;
(3)装置E的作用为:四氯化碳吸收未反应的SiHCl3,氢氧化钠溶液吸收HCl,还可以防止倒吸,
故答案为:四氯化碳吸收未反应的SiHCl3;氢氧化钠溶液吸收HCl;防止倒吸;
(4)先通入氢气,排尽装置中空气,再加热石英管,提高原理利用率,反应完毕停止通氢气,其合理顺序为:②⑤①④③,
故答案为:②⑤①④③;
(5)滴定终点时,氢氧化钠完全反应,溶液红色褪去,且半分钟不变色;
氢氧化钠物质的量等于生成的HCl与后加入HCl的物质的量之和,则生成HCl的物质的量=0.2L×1mol/L-0.02L×0.1mol/L×$\frac{200mL}{20mL}$=0.18mol,由SiHCl3+H2$\frac{\underline{\;1357K\;}}{\;}$Si+3HCl,可知参加反应SiHCl3为$\frac{0.18mol}{3}$=0.06mol,故SiHCl3的利用率为$\frac{0.06mol×135.5g/mol}{6.5mL×1.34g/mL}$×100%=93.34%,
故答案为:溶液红色褪去,且半分钟不变色;93.34;
(6)检验溶液中含有H+、Cl-可以证明生成HCl,具体实验方案为:取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸,
故答案为:取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸.
点评 本题考查物质制备实验方案设计,侧重考查学生获取信息和利用、基本操作能力,明确实验原理是解本题关键,题目难度中等.

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案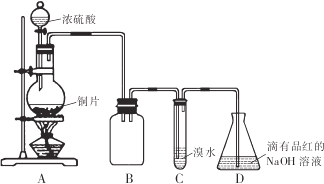
请回答下列问题:
(1)装置B的作用是防倒吸(或安全瓶)
(2)设计装置C的目的是验证SO2的还原性,装置C中发生反应的离子方程式是SO2+Br2+2H2O=4H++SO42-+2Br-.装置D中NaOH全部转化为NaHSO3的标志是溶液由红色变为无色.
(3)向NaHSO3溶液中加入NaCl0溶液时,反应有三种可能的情况:
I.HSO3-与ClO-恰好反应
Ⅱ.NaClO不足
Ⅲ.NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请完成下表:(已知酸性:H2SO3>H2CO3>HCl0)
| 序号 | 实 验操作 | 现 象 | 结 论 |
| ① | 加几小块CaCO3固体 | 有气泡产生 | I或Ⅱ |
| ② | 滴加少量淀粉KI溶液,振荡 | Ⅲ | |
| ③ | 滴加少量溴水,振荡 | Ⅱ | |
| ④ | 滴加少量酸性KMn04溶液、振荡 | 溶液为紫色 |
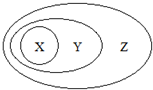 如图用交叉分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )
如图用交叉分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )| X | Y | Z | |
| A | CuSO4•5H2O | 盐 | 纯净物 |
| B | 胶体 | 分散系 | 混合物 |
| C | 碱性氧化物 | 氧化物 | 化合物 |
| D | 置换反应 | 氧化还原反应 | 离子反应 |
| A. | A | B. | B | C. | C | D. | D |
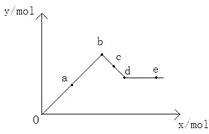
| A. | a-b时沉淀的物质的量:Al(OH)3比BaSO4多 | |
| B. | c-d时溶液中离子的物质的量:AlO2-比Ba2+多 | |
| C. | a-d时沉淀的物质的量:BaSO4可能小于Al(OH)3 | |
| D. | d-e时溶液中离子的物质的量:Ba2+可能等于OH- |
 某化学小组进行Na2SO3的性质实验探究.
某化学小组进行Na2SO3的性质实验探究.(1)在白色点滴板的a、b、c三个凹槽中滴有Na2SO3溶液,再分别滴加图所示的试剂:
实验现象如下表:
| 编号 | 实验现象 |
| a | 溴水褪色 |
| b | 产生淡黄色沉淀 |
| c | 滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去 |
①a中实验现象证明Na2SO3具有还原性性.
②b中发生反应的离子方程式是SO32-+2S2-+6H+=3S↓+3H2O.
③应用化学平衡原理解释c中现象(用化学用语及简单文字表述)在Na2SO3溶液中,SO32-水解显碱性:SO32-+H2O?HSO3-+OH-,所以滴入酚酞后溶液变红;在该溶液中加入BaCl2后,Ba2++SO32-═BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去
(2)在用NaOH溶液吸收SO2的过程中,往往得到Na2SO3和NaHSO3的混合溶液,溶液pH随n(SO${\;}_{3}^{2-}$):n(HSO${\;}_{3}^{-}$)变化关系如下表:
| n(SO${\;}_{3}^{2-}$ ):n(HSO${\;}_{3}^{-}$) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
A.c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-)
B.c(Na+)>c(HSO3-)>c(SO32-)>c(OH-)>c(H+)
C.c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
②若n(SO32-):n(HSO3-)=3:2,则0.8mol NaOH溶液吸收了标准状况下的SO211.2 L.
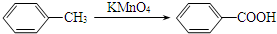
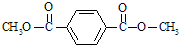 .
. .
.