题目内容
以下方法可以使醋酸溶液中H+浓度增大的是( )
| A、加入少量的CH3COONa固体 |
| B、加入少量NaOH固体 |
| C、加入少量NaHCO3固体 |
| D、通入少量HCl气体 |
考点:弱电解质在水溶液中的电离平衡
专题:
分析:醋酸是弱电解质,在溶液中存在电离平衡,要使溶液中c(H+)增大,则平衡向正反应方向移动,或加入酸等,以此解答该题.
解答:
解:A.溶液中存在CH3COOH?CH3COO-+H+,加入少量的CH3COONa固体,CH3COO-对CH3COOH的电离起到抑制作用,H+浓度减小,故A错误;
B.加入少量NaOH固体,发生中和反应,H+浓度减小,故B错误;
C.加入少量NaHCO3固体,消耗H+,H+浓度减小,故C错误;
D.通入少量HCl气体,H+浓度增大,故D正确.
故选D.
B.加入少量NaOH固体,发生中和反应,H+浓度减小,故B错误;
C.加入少量NaHCO3固体,消耗H+,H+浓度减小,故C错误;
D.通入少量HCl气体,H+浓度增大,故D正确.
故选D.
点评:本题考查弱电解质的电离,为高频考点,侧重考查学生分析问题和解决问题能力,难度中等,注意把握影响弱电解质的电离的影响因素.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
 如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cl-离子核间距为a cm,氯化铯的摩尔质量为M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )
如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cl-离子核间距为a cm,氯化铯的摩尔质量为M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )A、
| ||
B、
| ||
C、
| ||
D、
|
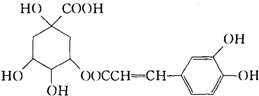 咖啡鞣酸具有较广泛的抗菌作用,其结构简式如图所示:1mol咖啡鞣酸与NaOH完全反应时可消耗 NaOH物质的量是( )
咖啡鞣酸具有较广泛的抗菌作用,其结构简式如图所示:1mol咖啡鞣酸与NaOH完全反应时可消耗 NaOH物质的量是( )| A、2 molNaOH |
| B、4 molNaOH |
| C、6 molNaOH |
| D、8 molNaOH |
下列各组物质能在同一溶液中大量共存的是( )
| A、CuSO4、H2SO4、HNO3 |
| B、Na2SO4、Ba(OH)2、CuCl2 |
| C、FeCl3、NaOH、KNO3 |
| D、K2SO4、NaOH、NaCl |
下列说法正确的是( )
| A、常温下0.1 mol/L的下列溶液①NH4Al(SO4)2②NH3?H2O③NH4Cl ④CH3COONH4中,c(NH4+)由大到小的顺序是:①>③>④>② |
| B、常温时,pH=2的CH3COOH溶液和pH=12的氨水等体积混合;pH=2的HCl溶液和pH=12的NaOH溶液等体积混合,各混合溶液中由水电离的c(H+)一定相等 |
| C、常温下0.4mol/L HB溶液和0.2mol/L NaOH溶液等体积混合后,则混合后溶液中离子浓度的大小顺序一定为:c(B-)>c(Na+)>c(H+)>c(OH-) |
| D、0.lmol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)>c(OH-) |
 在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子是( )
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子是( )| A、Mg2+、Al3+、Ba2+ |
| B、H+、Mg2+、Al3+ |
| C、H+、Cu2+、Al3+ |
| D、只有Mg2+、Al3+ |
金属的腐蚀造成了相当大的经济损失和环境污染,因此,人们想了很多方法防止金属的腐蚀.下面关于金属腐蚀的叙述正确的是( )
| A、铁壳轮船在河水中航行比在海水中航行更易被腐蚀 |
| B、常温下,铁易被干燥的氯气腐蚀 |
| C、钢铁发生吸氧腐蚀时,发生的负极反应为02+4e-+2H20═40H- |
| D、为了防止枪炮表面的钢铁被腐蚀,可以在钢铁表面进行烤蓝处理 |
下列反应现象中,叙述正确的是( )
| A、灼热的铁丝在氯气中燃烧,集气瓶内产生棕黄色烟雾 |
| B、氢气在氯气中燃烧,集气瓶口有白雾 |
| C、钠在氯气中燃烧,集气瓶内产生大量的白色烟雾 |
| D、灼热的铜丝在氯气中燃烧,集气瓶内产生棕红色烟 |
下列各组中的两物质相互作用时,若反应条件(如温度、反应物用量比例等)改变,产物的种类不会随之而改变的是( )
| A、Na和O2 |
| B、NaOH和CO2 |
| C、Na2CO3和HCl |
| D、NaHCO3和NaOH |