题目内容
8.在室温下,等体积的酸和碱的溶液混合后,pH一定小于7的是( )| A. | pH=3的硝酸跟pH=11的氢氧化钡溶液 | |
| B. | pH=3的盐酸跟pH=11的氨水 | |
| C. | pH=3硫酸跟pH=11的氢氧化钠溶液 | |
| D. | pH=3的醋酸跟pH=11的氢氧化钠溶液 |
分析 根据酸碱的强弱判断溶液中n(H+)与n(OH-)关系进行判断和计算.
解答 解:A、pH=3的硝酸中c(H+)=1×10-3mol/L,pH=11的氢氧化钡溶液中c(OH-)=1×10-3mol/L,在室温下等体积混合后,pH=7,故A错误;
B、pH=3的盐酸中c(H+)=1×10-3mol/L,pH=11的氨水中c(OH-)=1×10-3mol/L,由于氨水为弱碱,则氨水过量,在室温下等体积混合后,pH>7,故B错误;
C、pH=3的硫酸中c(H+)=1×10-3mol/L,pH=11的氢氧化钠溶液中c(OH-)=1×10-3mol/L,在室温下等体积混合后,pH=7,故C错误;
D、pH=3的醋酸跟pH=11的氢氧化钠溶液等体积混合后时,CH3COOH的物质的量大于NaOH的物质的量相等,酸剩余,故pH<7,故D正确;
故选D.
点评 本题考查酸碱混合时的定性判断及有关pH的计算,题目难度不大,注意判断酸碱的强弱并以此判断反应的过量问题.

练习册系列答案
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
18.下列无色透明溶液中能大量共存的离子组是( )
| A. | Na+、Al3+、HCO3-、NO3- | B. | OH-、Cl-、Mg2+、K+ | ||
| C. | NH4+、Na+、CH3COO-、NO3- | D. | Na+、NO3-、Fe3+、I- |
19.在下列溶液中,能大量共存的离子组是( )
| A. | 在强碱性溶液中能大量存在:Na+、K+、Cl-、NH4+ | |
| B. | 加入金属铝后溶液中有大量气泡产生的溶液中:Fe2+、Mg2+、NO3-、Cl- | |
| C. | 含有大量Fe3+的溶液中:SCN-、I-、K+、Br- | |
| D. | 溶液通入足量氨气后各离子还能大量存在:K+ Na+ OH-、CO32- |
3.在下列无色透明溶液中,各组离子一定能够大量共存的是( )
| A. | Al3+、Na+、Cl-、OH- | B. | Fe2+、Mg2+、SO42-、Cl- | ||
| C. | K+、Na+、CO32-、OH- | D. | Na+、Ba2+、HCO3-、OH- |
13.下列叙述正确的是( )
| A. | 铝元素是地壳中含量最多的元素 | |
| B. | 工业炼铝采用电解熔融的铝土矿的方法 | |
| C. | 冰晶石能使氧化铝熔融温度降低 | |
| D. | 工业上可用电解熔融氯化铝制取金属铝 |
17.下列反应离子方程式正确的是( )
| A. | 碳酸钙溶于稀盐酸中:CO32-+2H+═H2O+CO2↑ | |
| B. | 氯化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| C. | 铁与稀盐酸反应:2Fe+6H+═3H2↑+2Fe3+ | |
| D. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag |

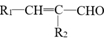 +H2O
+H2O +R2-OH$\stackrel{一定条件}{→}$
+R2-OH$\stackrel{一定条件}{→}$ .
. .
.