题目内容
 某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1
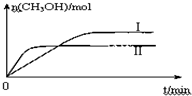
某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1测得CH3OH的物质的量随时间变化如图所示,回答问题:
①该反应的平衡常数表达式为K=
②曲线I、Ⅱ对应的平衡常数大小关系为KⅠ
③其它条件不变时,下列措施能提高H2转化率的是
A.减小CO2的浓度 B.降低温度 C.增加H2的浓度 D.增大压强.
考点:化学平衡常数的含义,化学平衡的影响因素
专题:
分析:①平衡常数表达式K=
;
②II平衡时间小于I,说明II反应速率大于I,且平衡时II中CH3OH的物质的量小于I,说明平衡向逆反应方向移动,则只能是升高温度,温度越高,化学平衡常数越小;
③提高H2转化率,则平衡向正反应方向移动,可以通过降低温度、增大压强、增大二氧化碳浓度或减小甲醇、水蒸气浓度实现.
| c(CH3OH).c(H2O) |
| c(CO2).c3(H2) |
②II平衡时间小于I,说明II反应速率大于I,且平衡时II中CH3OH的物质的量小于I,说明平衡向逆反应方向移动,则只能是升高温度,温度越高,化学平衡常数越小;
③提高H2转化率,则平衡向正反应方向移动,可以通过降低温度、增大压强、增大二氧化碳浓度或减小甲醇、水蒸气浓度实现.
解答:
解:①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)可知,K=
,故答案为:
;
②II平衡时间小于I,说明II反应速率大于I,且平衡时II中CH3OH的物质的量小于I,说明平衡向逆反应方向移动,则只能是升高温度,即II的温度大于I,温度越高,平衡向逆反应方向移动,导致化学平衡常数越小,所以KⅠ>KⅡ,故答案为:大于;
③提高H2转化率,则平衡向正反应方向移动,可以通过降低温度、增大压强、增大二氧化碳浓度或减小甲醇、水蒸气浓度实现,故选BD.
| c(CH3OH).c(H2O) |
| c(CO2).c3(H2) |
| c(CH3OH).c(H2O) |
| c(CO2).c3(H2) |
②II平衡时间小于I,说明II反应速率大于I,且平衡时II中CH3OH的物质的量小于I,说明平衡向逆反应方向移动,则只能是升高温度,即II的温度大于I,温度越高,平衡向逆反应方向移动,导致化学平衡常数越小,所以KⅠ>KⅡ,故答案为:大于;
③提高H2转化率,则平衡向正反应方向移动,可以通过降低温度、增大压强、增大二氧化碳浓度或减小甲醇、水蒸气浓度实现,故选BD.
点评:本题考查了化学平衡常数的含义,化学平衡移动影响因素即可解答,注意③中增大氢气浓度,平衡虽然向正反应方向移动,但氢气的转化率减小,②中要根据II、I两条曲线变化确定温度高低,从而确定化学平衡常数,为解答难点.

练习册系列答案
相关题目
进行实验必须注意安全,下列说法正确的是( )
| A、不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
| B、不慎将浓碱溶液沾到皮肤上,要立即用盐酸冲洗 |
| C、用点燃的火柴在液化气钢瓶口检验是否漏气 |
| D、配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
下列电池工作时,O2在正极放电的是( )
 |  |  |  |
| A.锌锰电池 | B.氨燃料电池 | C.铅蓄电池 | D.镍镉电池 |
| A、A | B、B | C、C | D、D |
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法.流程如下:CrO
Cr2O
Cr3+
Cr(OH)3↓,其中第①步中存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O.下列有关说法正确的是( )
2- 4 |
| H+ |
| ①转化 |
2- 7 |
| fe2+ |
| ②还原 |
| 沉淀剂a |
| ③沉淀 |
| A、第①步当2c (Cr2O72-)=c(CrO42-)时,达到了平衡状态 |
| B、对于上述平衡,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO42-的生成 |
| C、Cr(OH)3是一种两性氢氧化物,所以像Al(OH)3一样能溶于氨水和碳酸溶液中 |
| D、第②步中,还原0.1 mol Cr2O72-需要91.2 g FeSO4 |
下列微粒属于等电子体的是( )
| A、N2 与O2 |
| B、CO与N2 |
| C、NO2 与O3 |
| D、HCl和H2S |
对于淀粉和纤维素[(C6H10O5)n]的叙述,正确的是( )
| A、互为同分异构体 |
| B、都是天然有机高分子化合物 |
| C、遇碘(I2)均会呈蓝色 |
| D、在人体内均会发生水解反应 |