题目内容
(1)1mol/L的CaCl2 溶液0.5L,Cl-离子的物质的量浓度为 mol/L
(2)标准状况下,33.6L的NH3所具有的物质的量为 mol,将其溶解于水配成1L的溶液,则溶液的物质的量浓度为 mol/L.
(2)标准状况下,33.6L的NH3所具有的物质的量为
考点:物质的量浓度的相关计算
专题:
分析:(1)c(Cl-)=2c(CaCl2);
(2)33.6L氨气的物质的量=
=1.5mol,根据c=
计算氨水浓度.
(2)33.6L氨气的物质的量=
| 33.6L |
| 22.4L/mol |
| n |
| V |
解答:
解:(1)c(Cl-)=2c(CaCl2)=2×1mol/L=2mol/L,故答案为:2;
(2)33.6L氨气的物质的量=
=1.5mol,c=
=
=1.5mol/L,故答案为:1.5;1.5.
(2)33.6L氨气的物质的量=
| 33.6L |
| 22.4L/mol |
| n |
| V |
| 1.5mol |
| 1L |
点评:本题考查了物质的量浓度的计算,根据物质的量浓度公式结合化学式来分析解答,注意(1)中物质浓度与离子浓度的关系,为易错点.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案
相关题目
铜粉放入稀硫酸中,加热后无现象,当加入一点盐后,铜粉质量减少,新加入的盐可能是下列中的( )
| A、氯化物 | B、硫酸盐 |
| C、硝酸盐 | D、磷酸盐 |
自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS).由此可知下列分析正确的是( )
| A、原生铜的硫化物具有还原性,而铜蓝没有还原性 |
| B、整个过程涉及的反应类型有氧化还原反应和复分解反应 |
| C、CuSO4与ZnS反应的离子方程式是Cu2++S2-=CuS↓ |
| D、KSP(PbS)<Kap(CuS) |
相同质量的下列脂肪烃,在空气中充分燃烧产生二氧化碳最多的是( )
| A、C2H2 |
| B、CH4 |
| C、C2H4 |
| D、CH3OH |
下列叙述中正确的是( )
| A、常温下,10mlpH=12的氢氧化钠溶液中加入10mlpH=2的HA,所得溶液pH≤7 |
| B、25℃时,0.1mol/L与0.01mol/L的氯化铵溶液的pH前者大 |
| C、室温时浓度均为0.1mol/L的NH3?H2O和NH4Cl的混合液,pH为10,则,c(NH4+)+c(H+)<c(NH3?H2O)+c(OH-) |
| D、0.1mol/LNa2S溶液:c(Na+)>c(S2-)>c(HS-)>c(OH-)>c(H+) |
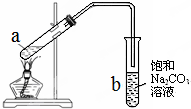 如图为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中,不正确的是( )
如图为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中,不正确的是( )| A、向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 |
| B、实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率 |
| C、试管b中Na2CO3的作用是除去随乙酸乙酯蒸出的少量乙酸和乙醇,降低乙酸乙酯在溶液中溶解度 |
| D、试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象 |
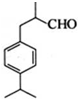 是一种重要的香料.用有机物I为原料可以合成兔耳草醛,其合成路线如图所示:
是一种重要的香料.用有机物I为原料可以合成兔耳草醛,其合成路线如图所示: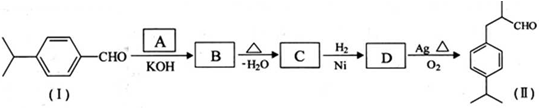
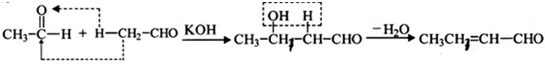
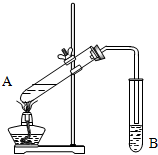 实验室用如图所示装置制取乙酸乙酯.
实验室用如图所示装置制取乙酸乙酯.