题目内容
11.下列单质或化合物的性质描述正确的是( )| A. | NaHC03水溶液显碱性,溶液中阳离子电荷总数小于阴离子电荷总数 | |
| B. | SiO2不跟碱反应,但可与氢氟酸反应 | |
| C. | NO2难液化,易溶于水并跟水反应 | |
| D. | Fe3O4能与浓盐酸反应生成FeCl2和FeCl3 |
分析 A.根据溶液中电荷守恒判断;
B.根据二氧化硅属于酸性氧化物判断;
C.NO2易液化,易溶于水并跟水反应;
D.根据Fe3O4为氧化铁与氧化亚铁按照1:1组合判断.
解答 解:A.根据电荷守恒,溶液中阳离子电荷总数等于阴离子电荷总数,故A错误;
B.二氧化硅属于酸性氧化物,能与烧碱溶液反应生成硅酸钠与水,故B错误;
C.NO2易液化,易溶于水并跟水反应硝酸和一氧化氮,故C错误;
D.Fe3O4为氧化铁与氧化亚铁按照1:1组合,所以与浓盐酸反应生成FeCl2和FeCl3,故D正确;
故选D.
点评 本题综合考查元素化合物知识,为高考常见题型,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,注意把握相关基础知识的积累,难度不大.

练习册系列答案
相关题目
2.向某密闭容器中充入1molCO和2molH2O(g),发生反应CO+H2O(g)$?_{△}^{催化剂}$CO2+H2当反应达到平衡时,CO的体积分数为x.若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分子大于x的是( )
| A. | 0.5mol CO+2mol H2O(g)+1mol CO2+1mol H2 | |
| B. | 1mol CO+1mol H2O(g)+1mol CO2+1mol H2 | |
| C. | 0.5mol CO+1.5mol H2O(g)+0.4mol CO2+0.4molH2 | |
| D. | 0.5mol CO+1.5mol H2O(g)+0.5molCO2+0.5mol H2 |
3.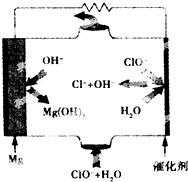 镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点.如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )
镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点.如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )
 镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点.如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )
镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点.如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )| A. | 该燃料电池中镁为负极,发生氧化反应 | |
| B. | 正极反应式为ClO-+H2O+2e-═Cl-+2OH- | |
| C. | 电池总反应式为Mg+ClO-+H2O═Mg(OH)2↓+Cl- | |
| D. | 放电过程中OH-移向正极 |
7.结合化学与环境相关知识,下列有关说法正确的是( )
| A. | SO2、NO2、CO2均属于大气污染物 | |
| B. | 酸雨是pH小于5.6的降水 | |
| C. | CO2也会导致酸雨的形戒 | |
| D. | 大气中O2含量的增加会导致温室效应加剧 |
16.已知PbO2受热分解为Pb的+4和+2价的混合氧化物,其中PbO2能氧化浓盐酸生成Cl2.现加热分解1moI PbO2得到O2和剩余固体,再向剩余固体中加入足量的浓盐酸得到Cl2,O2和Cl2的物质的量之比为1:2,则加热分解后剩余固体的组成及物质的量之比是( )
| 选项 | 剩余固体 | 剩余固体的物质的量之比 |
| A | Pb3O4,PbO | 1:1 |
| B | PbO2,Pb3O4 | 1:1 |
| C | PbO2,Pb3O4,PbO | 1:2:1 |
| D | PbO2,Pb3O4,PbO | 1:1:2 |
| A. | A | B. | B | C. | C | D. | D |
3.NA表示阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 5.6g铁粉与7.1g Cl2充分反应,转移电子数0.3NA | |
| B. | 1.7g羟基与1.6g甲烷分子所含电子数分别是0.9NA和NA | |
| C. | 3mol NO2与水充分反应时转移电子数2NA | |
| D. | 87g MnO2与含4NA HCl的浓盐酸加热反应,生成的氯气在标准状况下体积小于22.4L |
19.水溶液中能大量共存的一组离子是( )
| A. | NH4+、Ba2+、Br-、CO32- | B. | K+、Na+、SO42-、MnO4- | ||
| C. | Na+、H+、NO3-、HCO3- | D. | Cl-、NO3-、Fe2+、H+ |