题目内容
下列装置或操作能达到相应实验目的是( )
A、 构成锌-铜原电池 |
B、 证明铁生锈与空气有关 |
C、 制备乙酸乙酯 |
D、 证明乙醇发生消去反应生成了乙烯 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.电极位置错误;
B.在NaCl溶液中发生吸氧腐蚀;
C.导管不能插入液面以下;
D.乙醇在浓硫酸的催化下在170℃消去生成乙烯.
B.在NaCl溶液中发生吸氧腐蚀;
C.导管不能插入液面以下;
D.乙醇在浓硫酸的催化下在170℃消去生成乙烯.
解答:
解:A.原电池必须有自发的氧化还原反应,选项中左池能发生反应,反Zn电极和Cu电极不能形成原电池,正确的图应为 ,可构成原电池,故A错误;
,可构成原电池,故A错误;
B.铁在NaCl溶液中发生吸氧腐蚀,瓶内压强减小,水柱左边高,可证明,故B正确;
C.制备乙酸乙酯,导管不能插入液面以下,防止倒吸,故C错误;
D.乙醇在浓硫酸的催化下在170℃消去生成乙烯,应用蒸馏烧瓶并测反应温度,故D错误.
故选B.
 ,可构成原电池,故A错误;
,可构成原电池,故A错误;B.铁在NaCl溶液中发生吸氧腐蚀,瓶内压强减小,水柱左边高,可证明,故B正确;
C.制备乙酸乙酯,导管不能插入液面以下,防止倒吸,故C错误;
D.乙醇在浓硫酸的催化下在170℃消去生成乙烯,应用蒸馏烧瓶并测反应温度,故D错误.
故选B.
点评:本题考查实验设计的评价,题目难度不大,注意形成原电池的条件以及工作原理,为该题的易错点.

练习册系列答案
 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
化学与人类生活密切相关,下列说法不正确的是( )
| A、脂肪、糖类和蛋白质都是人体重要的营养物质 |
| B、将“地沟油”变废为宝,可制成生物柴油和肥皂 |
| C、污水处理的常用化学方法有:混凝法、中和法、沉淀法 |
| D、煤炭在国民经济中的地位和作用是十分重要的,被誉为“黑色的金子”、“工业的血液” |
已知2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.在25℃时,向恒压密闭容器中通入2molSO2和1mol O2,达到平衡时放出热量a1;若25℃时在此恒压密闭容器中只通入1molSO2和0.5molO2,达到平衡时放出热量a2.则下列关系正确的是( )
| A、2a2=a1=197 kJ |
| B、197 kJ>a1=2a2 |
| C、a2>a1>197 kJ |
| D、2a2<a1<197 kJ |
在标准状况下,把CO2和O2组成的混合气体10L通入足量的Na2O2,充分反应后,气体体积缩小到8L,则原混合气体中O2的体积是( )
| A、7 L |
| B、6 L |
| C、5 L |
| D、4 L |
在一定条件下,甲酸甲酯与水蒸气反应的热化学方程式为:HCOOCH3(g)+H2O(g)?HCOOH(g)+CH3OH(g)△H=+40.8kJ/mol,甲实验:在温度T1下,在2L恒容密闭系中各组分的起始物质的量如下表:
达平衡时,甲酸甲酯的浓度为3.00mol/L.
乙实验:在温度T1下,在2L恒容密闭系中只加入3.00mol HCOOCH3和3.00mol H2O,下列说法不正确的是( )
| 组分 | HCOOCH3 | H2O | HCOOH | CH3OH |
| n/mol | 8.00 | 12.00 | 1.00 | 3.00 |
乙实验:在温度T1下,在2L恒容密闭系中只加入3.00mol HCOOCH3和3.00mol H2O,下列说法不正确的是( )
| A、甲实验达到平衡时,反应吸收的热量为81.6kJ |
| B、乙实验中当HCOOCH3、H2O的浓度分别为1.00mol/L、1.00mol/L时反应达平衡状态 |
| C、乙实验中甲酸甲酯的平衡转化率大于甲实验中甲酸甲酯的平衡转化率 |
| D、若要使达到平衡时甲实验和乙实验的混合气体中甲酸的百分含量相同,可采取的措施是降低甲的温度 |
与氢气完全加成后,不可能生成2,2,3-三甲基戊烷的烃是( )
| A、HC≡CCH(CH3)C(CH3)3 |
| B、CH2=CHC(CH3)2CH(CH3)2 |
C、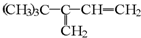 |
| D、(CH3)3CC(CH3)=CHCH3 |
人体中含量最高的电解质是( )
| A、水 | B、氯化钠 | C、蛋白质 | D、脂肪 |