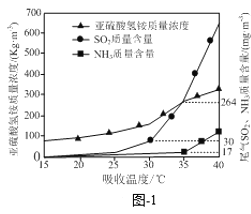
题目内容
【题目】测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
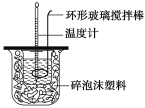
(1)写出该反应的热化学方程式(中和热为57.3 kJ·mol-1):_____。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如表。
①请填写表中的空白:
温度 实验次数 | 起始温度T1/℃ | 终止温度 T2/℃ | 温度差平 均值(T2 -T1)/℃ | ||
H2SO4 溶液 | NaOH 溶液 | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ___ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol·L-1NaOH溶液和0.50mol·L-1硫酸溶液的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18J·g-1·℃-1。则中和热ΔH=____(取小数点后一位)。
③上述实验数值结果与57.3kJ·mol-1有偏差,产生偏差的原因可能是____(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
【答案】![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l) ΔH=-57.3kJ·mol-1 4.0 -53.5 kJ·mol-1 acd
Na2SO4(aq)+H2O(l) ΔH=-57.3kJ·mol-1 4.0 -53.5 kJ·mol-1 acd
【解析】
(1)根据中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,标注物质聚集状态和对应焓变写出热化学方程式;
(2)①先判断温度差的有效性,然后求出温度差平均值;
②根据Q=mc△T计算出反应放出的热量,然后计算出生成1mol水放出的热量,就可以得到中和热;
③根据中和热的实验的关键是尽可能减少热量散失进行所测结果偏低的原因分析解答。
(1)稀强酸、稀强碱反应生成1mol液态水时放出57.3kJ的热量,稀硫酸和稀氢氧化钠反应的中和热的热化学方程式为![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l) ΔH=-57.3kJ·mol-1,故答案为:
Na2SO4(aq)+H2O(l) ΔH=-57.3kJ·mol-1,故答案为:![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l) ΔH=-57.3kJ·mol-1;
Na2SO4(aq)+H2O(l) ΔH=-57.3kJ·mol-1;
(2)①由表格可知4次温度差分别为:4.0℃、6.1℃、4.1℃、3.9℃,第2组误差较大舍去,则3次温度差平均值为![]() =4.0℃,故答案为:4.0;
=4.0℃,故答案为:4.0;
②50mL 0.50molL-1NaOH溶液与30mL 0.50molL-1硫酸溶液进行中和反应生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为80ml×1gcm-3=80g,温度变化的值为△T=4.0℃,则生成0.025mol水放出的热量为Q=mc△T=80g×4.18J/(g℃)×4.0℃=13376J,即1.3376kJ,所以实验测得的中和热△H=—![]() =-53.5kJ/mol,故答案为:-53.5kJ/mol;
=-53.5kJ/mol,故答案为:-53.5kJ/mol;
③a、装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故正确;
b、量取NaOH溶液时仰视刻度,导致所取氢氧化钠溶液的体积偏大,参与反应的氢氧化钠的物质的量偏大,反应放出的热量偏大,中和热的数值偏高,故错误;
c、多次把NaOH溶液倒入盛有硫酸的小烧杯中,热量散失,测得的热量偏小,中和热的数值偏小,故正确;
d、用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故正确;
acd正确,故答案为:acd。

【题目】某学习小组用0.80 mol/L标准浓度的烧碱溶液测定未知浓度的盐酸。
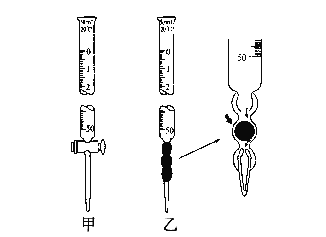
(1).滴定管如图所示,用______滴定管盛装标准浓度的氢氧化钠溶液 (填“甲”或“乙”)。
(2).用滴定的方法来测定盐酸的浓度,实验数据如下所示:
实验编号 | 待测HCl溶液的体积/mL | 滴入NaOH溶液的体积/mL |
1 | 20.00 | 23.00 |
2 | 20.00 | 23.10 |
3 | 20.00 | 22.90 |
该实验中用去标准液的体积为________ml。
(3).下列操作会使所测得的盐酸的浓度偏低的是________。
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数
(4).滴定过程中,眼睛应注视________;在铁架台上垫一张白纸,其目的是_______________;
若用酚酞作指示剂,则判断达到滴定终点时的现象是__________________。
(5).根据上表数据,计算被测盐酸的物质的量浓度是________mol/L。(小数点后保留两位有效数字)