题目内容
【题目】某学习小组用0.80 mol/L标准浓度的烧碱溶液测定未知浓度的盐酸。
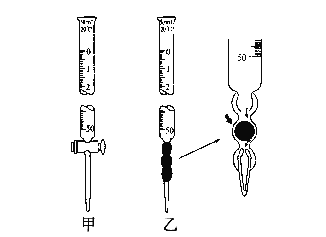
(1).滴定管如图所示,用______滴定管盛装标准浓度的氢氧化钠溶液 (填“甲”或“乙”)。
(2).用滴定的方法来测定盐酸的浓度,实验数据如下所示:
实验编号 | 待测HCl溶液的体积/mL | 滴入NaOH溶液的体积/mL |
1 | 20.00 | 23.00 |
2 | 20.00 | 23.10 |
3 | 20.00 | 22.90 |
该实验中用去标准液的体积为________ml。
(3).下列操作会使所测得的盐酸的浓度偏低的是________。
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数
(4).滴定过程中,眼睛应注视________;在铁架台上垫一张白纸,其目的是_______________;
若用酚酞作指示剂,则判断达到滴定终点时的现象是__________________。
(5).根据上表数据,计算被测盐酸的物质的量浓度是________mol/L。(小数点后保留两位有效数字)
【答案】乙 23.00ml D 锥形瓶内溶液颜色的变化 便于观察锥形瓶内液体颜色的变化,减小滴定误差 当滴入最后一滴氢氧化钠溶液,溶液刚好由无色变为粉红色,且半分钟内不恢复原色(或不褪色) 0.92 mol·L-1
【解析】
(1)NaOH溶液显碱性,故应用碱式滴定管盛装标准浓度的氢氧化钠溶液;
(2)根据表格中数据,求出平均消耗V(NaOH);
(3)根据c(待测)=c(标准)V(标准)/V(待测)判断误差;
(4)滴定时,滴定过程中两眼应该注视锥形瓶内溶液的颜色变化;在盛放待测溶液的锥形瓶下方放一张白纸的作用是观察锥形瓶中溶液颜色的变化明显,减少实验误差;当滴入最后一滴氢氧化钠溶液,溶液刚好由无色变为粉红色,且半分钟内不恢复原色(或不褪色);
(5)根据n(HCl)=n(NaOH)计算被测盐酸的物质的量浓度。
(1)NaOH溶液显碱性,故应用碱式滴定管盛装标准浓度的氢氧化钠溶液,故答案为:乙。
(2)根据表格中数据,平均消耗V(NaOH)=(23.00+23.10+22.90)/3mL=23.00mL,故答案为:23.00。
(3)A.盛装待测液的锥形瓶用水洗后未干燥,不会产生误差,故A不符合;
B.滴定前,碱式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=c(标准)V(标准)/V(待测)可知,测定c(HCl)偏大,故B不符合;
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗,测定V(HCl)偏大,根据c(待测)=c(标准)V(标准)/V(待测)可知,测定c(HCl)偏大,故C不符合;
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数,造成V(标准)偏小,根据c(待测)=c(标准)V(标准)V(待测)可知,测定c(HCl)偏低,故D符合。
故答案为:D。
(4)滴定时,滴定过程中两眼应该注视锥形瓶内溶液的颜色变化,在盛放待测溶液的锥形瓶下方放一张白纸的作用是观察锥形瓶中溶液颜色的变化明显,减少实验误差;
当滴入最后一滴氢氧化钠溶液,溶液刚好由无色变为粉红色,且半分钟内不恢复原色(或不褪色),可说明达到滴定终点;
故答案为:锥形瓶内溶液的颜色变化;便于观察锥形瓶内液体颜色的变化,减小滴定误差;
当滴入最后一滴氢氧化钠溶液,溶液刚好由无色变为粉红色,且半分钟内不恢复原色(或不褪色)。
(5)n(HCl)=c(HCl)×20.00mL,n(NaOH)=0.80mol/L×23.00mL,根据反应方程式HCl+NaOH=NaCl+H2O可知,n(HCl)=n(NaOH),
即c(HCl)=0.80mol/L×23.00mL/20.00mL=0.92mol·L-1
故答案为:0.92mol·L-1。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案