题目内容
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、在标准状况下22.4L H2O中含有氢原子的个数为2NA |
| B、2.7g 铝与足量的盐酸反应时失去的电子数为0.3NA |
| C、1mol/L NaCl溶液中含有钠离子的个数为NA |
| D、常温常压下,11.2 L氧气含有的原子数目为NA |
考点:阿伏加德罗常数
专题:
分析:A.标况下,水为液态;
B.金属铝为3价金属,1mol铝完全反应失去3mol电子;
C.溶液体积不知;
D.依据气体摩尔体积应用条件分析,标准状况气体摩尔体积为22.4L/mol.
B.金属铝为3价金属,1mol铝完全反应失去3mol电子;
C.溶液体积不知;
D.依据气体摩尔体积应用条件分析,标准状况气体摩尔体积为22.4L/mol.
解答:
解:A.标况下,水为液态,故22.4LH2O的物质的量不是1mol,含有氢原子数不是2NA个,故A错误;
B.2.7g铝的物质的量为0.1mol,与足量的盐酸反应失去0.3mol电子,提供的电子数为0.3NA,故B正确;
C.溶液体积不知不能计算微粒物质的量,故C错误;
D.依据气体摩尔体积应用条件分析,标准状况气体摩尔体积为22.4L/mol,常温常压下,11.2L氧气物质的量小于0.5mol,故D错误.
故选B.
B.2.7g铝的物质的量为0.1mol,与足量的盐酸反应失去0.3mol电子,提供的电子数为0.3NA,故B正确;
C.溶液体积不知不能计算微粒物质的量,故C错误;
D.依据气体摩尔体积应用条件分析,标准状况气体摩尔体积为22.4L/mol,常温常压下,11.2L氧气物质的量小于0.5mol,故D错误.
故选B.
点评:本题考查阿伏加德罗常数的相关计算,题目难度不大,注意物质的组成、结构、性质以及物质存在的外界条件和聚集状态等问题.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
下列离子检验的方法正确的是( )
| A、某溶液中滴加AgNO3溶液有白色沉淀,说明原溶液中有Cl- |
| B、某溶液中先滴加足量盐酸无现象,再滴加BaCl2溶液有白色沉淀,则原溶液中有SO42- |
| C、某无色溶液滴入酚酞试液显红色,该溶液一定是含有大量的H+ |
| D、某溶液中滴加稀硫酸生成无色气体,说明原溶液中有CO32- |
用下列实验装置进行相应的实验,能达到实验目的是( )
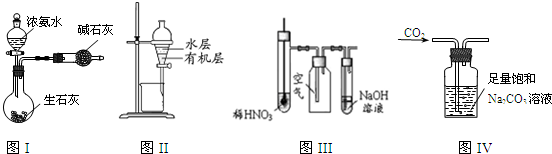

| A、图I所示装置制取干燥的氨气 |
| B、图Ⅱ所示装置用于提取I2的CCl4溶液中的I2 |
| C、图Ⅲ所示装置微热稀HNO3,在广口瓶中可收集NO气体 |
| D、图IV所示装置可用于除去CO2中含有的少量HCl |
下列化学用语正确的是( )
A、水的电子式: |
B、氯化钠的电子式: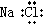 |
| C、KClO3的电离方程式:KClO3=K++Cl-+3O2- |
| D、碳酸氢钠的电离方程式:NaHCO3=Na++HCO3- |
下列离子在给定的条件下一定能大量共存的是( )
| A、pH=1的溶液中:Na+、K+、MnO4-、CO32- |
| B、0.1 mol/L NH4HCO3溶液中:K+、Na+、NO3-、Cl- |
| C、c(Fe3+)=0.1 mol/L的溶液中:NH4+、Cl-、AlO2-、SO42- |
| D、室温下,水电离出的c(H+)=1×10-13mo1/L的溶液中:Mg2+、K+、NO3-、Cl- |
某共价化合物含C、H、N 3种元素,已知其分子内的4个氮原子排列成内空的四面体结构,且每2个氮原子之间都有1个碳原子,分子中无C-C、C═C、C≡C键,则此化合物的化学式是( )
| A、C6H12N4 |
| B、C4H8N4 |
| C、C6H10N4 |
| D、C6H8N4 |
