题目内容
10.一种生产聚苯乙烯的流程如下:
下列叙述不正确的是( )
| A. | 苯乙烯的分子式为C8H8 | |
| B. | 1mol苯乙烯最多可与4molH2发生加成反应 | |
| C. | 鉴别乙苯与苯乙烯可用Br2的四氯化碳溶液 | |
| D. | 乙烯、苯和乙苯的分子中所有原子均可处于同一平面 |
分析 由合成流程可知,①为苯与乙烯的加成反应,②为乙苯的消去反应,③为苯乙烯的加聚反应,
A.苯乙烯分子含8个C、8个H;
B.苯乙烯中苯环、碳碳双键均与氢气发生加成反应;
C.苯乙烯含碳碳双键,而苯不含;
D.乙烯、苯为平面结构,而乙苯中侧链2个C均为四面体构型.
解答 解:A.苯乙烯分子含8个C、8个H,可知分子式为C8H8,故A正确;
B.苯乙烯中苯环、碳碳双键均与氢气发生加成反应,则1mol苯乙烯最多可与4molH2发生加成反应,故B正确;
C.苯乙烯含碳碳双键,而苯不含,苯乙烯与Br2的四氯化碳溶液反应,可鉴别,故C正确;
D.乙烯、苯为平面结构,而乙苯中侧链2个C均为四面体构型,则乙苯中所有原子不可能共面,故D错误;
故选D.
点评 本题考查有机物的合成及结构与性质,为高频考点,把握官能团与性质的关系、有机反应、有机物的结构为解答的关键,侧重分析与应用能力的考查,注意选项D中共面判断为解答的难点,题目难度不大.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
1.海洋约占地球表面的71%,具有十分巨大的开发潜力,目前的南海争端威胁到我们国家的核心利益.通过海水资源的开发利用不能得到的是( )
| A. | 石油、天然气 | B. | 乙醇、乙酸 | C. | 淡水 | D. | 钠、钾、镁、溴 |
5.下列化学反应的能量变化与如图不符合的是( )
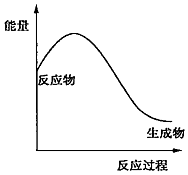

| A. | 2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O | |
| B. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | |
| C. | Mg+2HCl=MgCl2+H2↑ | |
| D. | C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2 |
15.被称为“软电池”的纸质电池,采用一个薄层纸片(在其一边镀锌,在其另一边镀二氧化锰)作为传导体.在纸内的离子“流过”水和氧化锌组成的电解液.电池总反应为Zn+2MnO2+H2O═ZnO+2MnO(OH)下列说法不正确的是( )
| A. | 该电池锌为负极,发生氧化反应 | |
| B. | 电池正极反应式为MnO2+e-+H2O═MnO(OH)+OH- | |
| C. | 当0.1mol Zn完全溶解时,电池外电路转移的电子个数约为1.204×1023 | |
| D. | 当该电池工作时,负极周围的pH值变大 |
2.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,22.4L苯中含σ键数目为12NA | |
| B. | 常温下,9.2gNO2和N2O4的混合气体中含有的氮原子数目为0.2NA | |
| C. | 常温下,1.0L 0.1 mol•L-1 FeCl3溶液中,Fe3+离子数目为0.1NA | |
| D. | O3氧化NO 结合水洗可产生HNO3和O2,每生成1mol HNO3转移的电子数为6NA |
19.下列解释事实的方程式不正确的是( )
| A. | 电解饱和食盐水,产生黄绿色气体:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑ | |
| B. | 用Na2CO3溶液将水垢中的CaSO4转化为CaCO3:CO32-+Ca2+=CaCO3 | |
| C. | 向H2O2溶液中滴加CuSO4溶液,产生气泡:2H2O2 $\frac{\underline{\;CuSO_{4}\;}}{\;}$2H2O+O2↑ | |
| D. | 向苯酚浊液中滴加Na2CO3溶液,溶液变澄清: |
1.同温同压下,x g甲气体和y g乙气体占有相同的体积,根据阿伏伽德罗定律判断,x:y的值可以表示( )
| A. | 甲与乙的物质的量之比 | |
| B. | 等质量的甲与乙的分子个数之比 | |
| C. | 同温同压下,甲与乙的密度之比 | |
| D. | 同温同体积下,等质量的甲与乙的压强之比 |
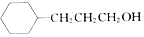 ,流程如下
,流程如下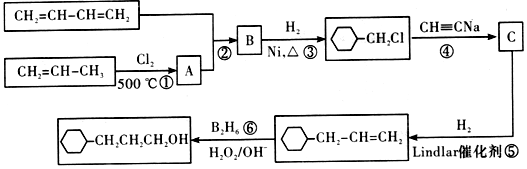
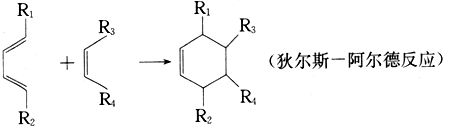
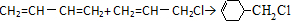
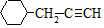
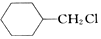 含有六元环且核磁共振氢谱有4组峰值的同分异构体的结构筒式
含有六元环且核磁共振氢谱有4组峰值的同分异构体的结构筒式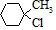
 某有机物含C、H、N、O四种元素,下图为该有机物球棍模型.
某有机物含C、H、N、O四种元素,下图为该有机物球棍模型.