题目内容
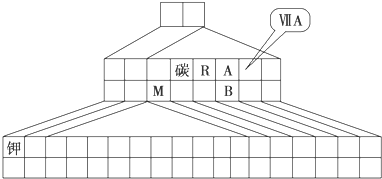
如图是元素周期表的一部分.表中所列的字母分别代表某一种化学元素.

(1)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子或离子所需要的能量主要受两大因素的影响:一是原子核对核外电子的吸引力;二是形成稳定结构的倾向.
下表是一些气态原子失去核外不同电子所需的能量(KJ.mol-1):
①表中X可能为以上13种元素中的
②Y是周期表中
③以上13种元素中,
(2)若表中X和Y均为短周期元素,则X的元素符号是

(1)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子或离子所需要的能量主要受两大因素的影响:一是原子核对核外电子的吸引力;二是形成稳定结构的倾向.
下表是一些气态原子失去核外不同电子所需的能量(KJ.mol-1):
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 589 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
a
a
(填写字母)元素.用元素符号表示x和j形成化合物的化学式:Na2O、Na2O2
Na2O、Na2O2
②Y是周期表中
ⅢA
ⅢA
族元素.③以上13种元素中,
m
m
(填写字母)元素原子的第一电离能最大.(2)若表中X和Y均为短周期元素,则X的元素符号是
Na
Na
,元素Y的原子最外层有3
3
个电子.分析:(1)①由表中数据可知,X的第二电离能剧增,故X表现+1价,处于第ⅠA族,且第一电离能比Li的小,说明比锂的金属性强,应为周期表中的a元素,由元素在周期表的位置可知,a为Na元素,j为O元素,钠与氧气形成氧化钠、过氧化钠;
②由表中数据可知,Y的第四电离能剧增,故Y表现+3价,最外层电子数为3,应为ⅢA族元素;
③稀有气体的第一电离能最大;
(2)表中X和Y均为短周期元素,由(1)中分析可知,X为Na元素,Y表现+3价,最外层有3个电子.
②由表中数据可知,Y的第四电离能剧增,故Y表现+3价,最外层电子数为3,应为ⅢA族元素;
③稀有气体的第一电离能最大;
(2)表中X和Y均为短周期元素,由(1)中分析可知,X为Na元素,Y表现+3价,最外层有3个电子.
解答:解:(1)①由表中数据可知,X的第二电离能剧增,故X表现+1价,处于第ⅠA族,且第一电离能比Li的小,说明比锂的金属性强,应为周期表中的a元素,由元素在周期表的位置可知,a为Na元素,j为O元素,钠与氧气形成Na2O、Na2O2,
故答案为:a;Na2O、Na2O2;
②由表中数据可知,Y的第四电离能剧增,故Y表现+3价,最外层电子数为3,应为ⅢA族元素,故答案为:ⅢA;
③稀有气体的第一电离能最大,由元素在周期表中位置可知m为零族元素Ar,故答案为:m;
(2)表中X和Y均为短周期元素,由(1)中分析可知,X为Na元素,Y表现+3价,最外层有3个电子,故答案为:Na;3.
故答案为:a;Na2O、Na2O2;
②由表中数据可知,Y的第四电离能剧增,故Y表现+3价,最外层电子数为3,应为ⅢA族元素,故答案为:ⅢA;
③稀有气体的第一电离能最大,由元素在周期表中位置可知m为零族元素Ar,故答案为:m;
(2)表中X和Y均为短周期元素,由(1)中分析可知,X为Na元素,Y表现+3价,最外层有3个电子,故答案为:Na;3.
点评:本题考查元素周期表的结构、元素电离能与化合价关系等,难度中等,注意根据电离能确定元素的化合价.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 如图是元素周期表的一部分,X、Y、Z、W均为短周期元素,X、Z的质子数之和为21.下列说法正确的是( )
如图是元素周期表的一部分,X、Y、Z、W均为短周期元素,X、Z的质子数之和为21.下列说法正确的是( )| A、X元素最多可形成六种氧化物 | B、Y元素的最高价氧化物的水化物是含氧酸中酸性最强的 | C、X元素的非金属性比Y元素非金属性强 | D、Z和X能以共价键结合形成一种无机非金属材料 |