题目内容
(Ⅰ)如图1表示从固体混合物中分离X的方案,请回答有关问题.
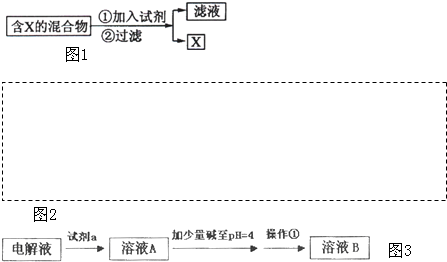
(1)若按照图示从某金属粉末(含有Au、Ag和Cu)中分离Au,加入的试剂是 ;
(2)为提纯某Fe2O3样品(主要杂质有SiO2、A12O3),请设计一种以框图形式表示(如图2)的实验方案(注明物质和操作).
(Ⅱ)在工业精炼铜的过程中,电解液中c(Cu2+)逐渐下降,c(Fe2+)、c(Zn2+)会逐渐增加,所以需定时除去其中的Fe2+、Zn2+.下表为部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
甲同学设计了如图3除杂方案:
(1)试剂a是 ,其目的是 ;根据溶度积该方案能够除去的杂质金属阳离子是 .写出检验该杂质金属阳离子的操作方法: .
(2)乙同学在查阅资料时发现,“工业原料氯化铵中含杂质氯化铁,使其溶入水,再加入氨水调节pH至7~8,可使Fe3+生成Fe(OH)3.沉淀而除去.”乙同学认为甲同学的方案中也应该将溶液pH调至7~8.你认为乙同学的建议是否正确? (填“是”或“否”),理由是 .

(1)若按照图示从某金属粉末(含有Au、Ag和Cu)中分离Au,加入的试剂是
(2)为提纯某Fe2O3样品(主要杂质有SiO2、A12O3),请设计一种以框图形式表示(如图2)的实验方案(注明物质和操作).
(Ⅱ)在工业精炼铜的过程中,电解液中c(Cu2+)逐渐下降,c(Fe2+)、c(Zn2+)会逐渐增加,所以需定时除去其中的Fe2+、Zn2+.下表为部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 5.6 | 6.2 |
| 完全沉淀 | 3.9. | 9.7 | 6.4 | 8.0 |
(1)试剂a是
(2)乙同学在查阅资料时发现,“工业原料氯化铵中含杂质氯化铁,使其溶入水,再加入氨水调节pH至7~8,可使Fe3+生成Fe(OH)3.沉淀而除去.”乙同学认为甲同学的方案中也应该将溶液pH调至7~8.你认为乙同学的建议是否正确?
考点:物质分离和提纯的方法和基本操作综合应用,难溶电解质的溶解平衡及沉淀转化的本质
专题:实验设计题
分析:(Ⅰ)(1)金属Au、Ag和Cu中的Ag和Cu均能与硝酸反应生成硝酸盐,而Au不能溶于硝酸,据此解答即可;
(2)二氧化硅和盐酸不反应,氧化铝和氧化铁可以溶解于盐酸中得到其氯化物,氯化铁可以和过量的强碱反应生成沉淀氢氧化铁,受热分解为氧化铁;
(Ⅱ)(1)电解液中的各种离子沉淀所需要的酸碱性情况不同,可以将亚铁离子氧化为三价铁,根据阳离子以氢氧化物形式沉淀时溶液的pH情况表和亚铁离子以及三价铁的性质来检验;
(2)甲同学的方案中若将溶液pH调至7~8,根据图示表中数据会发现铜离子也会被沉淀.
(2)二氧化硅和盐酸不反应,氧化铝和氧化铁可以溶解于盐酸中得到其氯化物,氯化铁可以和过量的强碱反应生成沉淀氢氧化铁,受热分解为氧化铁;
(Ⅱ)(1)电解液中的各种离子沉淀所需要的酸碱性情况不同,可以将亚铁离子氧化为三价铁,根据阳离子以氢氧化物形式沉淀时溶液的pH情况表和亚铁离子以及三价铁的性质来检验;
(2)甲同学的方案中若将溶液pH调至7~8,根据图示表中数据会发现铜离子也会被沉淀.
解答:
解:(Ⅰ)(1)Au不溶于硝酸,而Ag和Cu均能溶于硝酸,故利用硝酸将Ag和Cu变为硝酸盐溶液,然后过滤出Au即可,故答案为:硝酸;
(2)混合物中,二氧化硅和盐酸不反应,可以先加入盐酸将二氧化硅分离出来,氧化铝和氧化铁可以溶解于盐酸中得到氯化铁和氯化铝的混合物,加入过量的氢氧化钠,氯化铁可以和过量的强碱反应生成沉淀氢氧化铁,而氯化铝则转化为可溶的偏铝酸钠,过滤可以得到氢氧化铁,将之受热分解即为氧化铁,即 ,故答案为:
,故答案为: ;
;
(Ⅱ)(1)根据表中数据发现当三价铁离子形成沉淀时,铜离子不沉淀,可以将亚铁离子氧化为三价铁,再调节PH来除去亚铁离子,所以可以选择氧化剂双氧水,向加入双氧水后的溶液中加入KSCN溶液,若溶液不变红,再滴入几滴氯水,若溶液变成红色,说明含有亚铁,
故答案为:H2O2;将Fe2+氧化为Fe3+;Fe2+;先加入KSCN溶液,若溶液不变红,再滴入几滴氯水,若溶液变成红色,说明含有该离子;
(2)乙同学的建议不正确,因为根据沉淀时的pH,当溶液pH为7~8时,溶液A中的Cu2+同时会生成沉淀而被除去,
故答案为:否;根据沉淀时的pH,当溶液pH为7~8时,溶液A中Cu2+同时生成沉淀而被除去.
(2)混合物中,二氧化硅和盐酸不反应,可以先加入盐酸将二氧化硅分离出来,氧化铝和氧化铁可以溶解于盐酸中得到氯化铁和氯化铝的混合物,加入过量的氢氧化钠,氯化铁可以和过量的强碱反应生成沉淀氢氧化铁,而氯化铝则转化为可溶的偏铝酸钠,过滤可以得到氢氧化铁,将之受热分解即为氧化铁,即
 ,故答案为:
,故答案为: ;
;(Ⅱ)(1)根据表中数据发现当三价铁离子形成沉淀时,铜离子不沉淀,可以将亚铁离子氧化为三价铁,再调节PH来除去亚铁离子,所以可以选择氧化剂双氧水,向加入双氧水后的溶液中加入KSCN溶液,若溶液不变红,再滴入几滴氯水,若溶液变成红色,说明含有亚铁,
故答案为:H2O2;将Fe2+氧化为Fe3+;Fe2+;先加入KSCN溶液,若溶液不变红,再滴入几滴氯水,若溶液变成红色,说明含有该离子;
(2)乙同学的建议不正确,因为根据沉淀时的pH,当溶液pH为7~8时,溶液A中的Cu2+同时会生成沉淀而被除去,
故答案为:否;根据沉淀时的pH,当溶液pH为7~8时,溶液A中Cu2+同时生成沉淀而被除去.
点评:物质的分离提纯和鉴定是化学的难重点,也是考试的热点之一,了解物质的物性质,掌握常见离子的检验方法,是解题的关键.

练习册系列答案
相关题目
取一定质量的均匀固体混合物Cu、Cu2O和 CuO,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少6.40g,另一份中加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为( )
| A、3.6mol/L |
| B、3.2mol/L |
| C、2.8mol/L |
| D、2.4mol/L |
下列说法中不正确的是( )
| A、不需要加热就能发生的发应一定是放热反应 |
| B、吸热反应在常温下可能发生 |
| C、反应吸热还是放热,取决于反应物和生成物所具有的总能量的相对大小 |
| D、物质发生化学变化一定伴随着能量变化 |
3L Al2(SO4)3 溶液中含Al3+ag,则这种Al2(SO4)3 溶液的物质的量浓度为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列电离方程式不正确的是( )
| A、H2SO4═2H++SO42- |
| B、NH4NO3═NH4++NO3- |
| C、CaCO3═Ca2++CO32- |
| D、Ba(OH)2═Ba2++OH- |
下列变化需克服相同类型作用力的是( )
| A、氯化钠和金刚石的熔化 |
| B、干冰和C60的熔化 |
| C、氯化氢和氯化钾的溶解 |
| D、溴和汞的气化 |
下列有关化学用语错误的是 ( )
A、乙醇分子球棍模型: |
B、聚乙烯的结构简式 |
C、-OH的电子式: |
D、CH4Si的结构式: |
 用如图所示装置检验乙烯时不需要除杂的是( )
用如图所示装置检验乙烯时不需要除杂的是( ) .试回答:
.试回答: