题目内容
19.根据实验数据写出下列反应能表现燃烧热的热化学方程式:(1)沼气是一种能源,它的主要成分是CH4.0.5mol CH4完全燃烧生成CO2和液态H2O时,放出445kJ热量.CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol
(2)SiH4是一种无色气体,遇到空气与能O2作用发生爆炸性自燃,生成SiO2和H2O(l).已知室温下2g SiH4自燃放出热量89.2kJ.SiH4(g)+O2(g)=SiO2(g)+2H2O(l)△H=-1427.2kJ/mol.
分析 (1)0.5mol CH4完全燃烧生成CO2和液态H2O时,放出445kJ热量,1mol CH4完全燃烧生成CO2和液态H2O时,放出890kJ热量,标注物质聚集状态和对应反应焓变;
(2)根据甲硅烷的质量计算1mol甲硅烷燃烧放出的热量,结合化学方程式书写热化学方程式.注意物质的聚集状态和反应热的单位等问题;
解答 解:(1)0.5molCH4在O2中完全燃烧,放出445kJ的热量,即1molCH4在氧气中燃烧生成CO2和液态水,放出889kJ热量,则热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol;
(2)n(SiH4)=$\frac{2g}{32g/mol}$=$\frac{1}{16}$mol,则1molSiH4燃烧放出的热量为:89.2kJ×16=1427.2kJ,反应的化学方程式为:SiH4+O2=SiO2+2H2O,则热化学方程式为:SiH4(g)+O2(g)=SiO2(g)+2H2O(l);△H=-1427.2kJ/mol,
故答案为:SiH4(g)+O2(g)=SiO2(g)+2H2O(l)△H=-1427.2kJ/mol.
点评 本题主要考查了热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比,题目难度不大.

练习册系列答案
相关题目
7.下列描述的正确的是( )
| A. | Na2O2与水反应是水作还原剂的氧化还原反应 | |
| B. | 过氧化钠的电子式为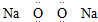 | |
| C. | 在过氧化钠与水的反应中,每生成0.1 mol氧气,转移电子的数目为0.4NA | |
| D. | 二氧化碳通过Na2O2粉末,反应后固体物质增重 |
4.下列行为中符合安全要求的是( )
| A. | 装运乙醇的包装箱上应贴上易燃液体的危险品标志图标 | |
| B. | 用点燃的火柴在液化气钢瓶口检验是否漏气 | |
| C. | 实验时,将水倒入浓硫酸中配制稀硫酸 | |
| D. | 进入煤矿井时,用火把照明 |
11.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 2.4g金属镁变成镁离子时失去的电子数为0.2NA | |
| B. | 常温常压下,1mol氦气所含原子数为2NA | |
| C. | 标准状况下,22.4L CCl4含有的氯原子数为4NA | |
| D. | 0.5mol•L-1 Na2CO3溶液中含有Na+离子的数目为NA |
9.下列微粒中半径最小的是( )
| A. | Ca2+ | B. | K | C. | S2- | D. | K+ |