题目内容
2.不同的卤素原子之间可以形成一系列化合物,这类化合物叫卤素互化物.现将4.66gBrClx溶于水后,通入足量SO2气体与其反应,生成氢溴酸、盐酸和硫酸.用碱将溶液调至中性后加入过量Ba(NO3)2溶液,充分反应后滤去沉淀物,再向溶液中加入过量的AgNO3溶液,最后得15.46g卤化银沉淀.(1)完成SO2与BrClx溶液发生反应的化学方程式.
(2)计算确定BrClx中x的值.
分析 氢溴酸、盐酸和硫酸混合溶液用碱将溶液调至中性后加入过量Ba(NO3)2,硫酸根转化为硫酸钡沉淀,充分反应后滤去沉淀物,再向滤液中加入过量的AgNO3溶液,最后得到卤化银沉淀15.46g为AgBr、AgCl,根据质量守恒可知,Ag元素的质量为15.46g-4.66g=10.8g,故其物质的量为0.1mol,根据Ag元素守恒计算参加反应的AgNO3的物质的量,由Ag守恒可知AgBr、AgCl总物质的量为0.1mol,结合二者总质量列方程计算各自物质的量,根据原子守恒计算BrClx中x的值.
解答 解:BrClx溶于水后,通入足量SO2气体与其反应,生成氢溴酸、盐酸和硫酸,反应方程式为:(2x+2)H2O+(x+1)SO2+2BrClx=(x+1)H2SO4+2HBr+2xHCl,氢溴酸、盐酸和硫酸混合溶液用碱将溶液调至中性后加入过量Ba(NO3)2,硫酸根转化为硫酸钡沉淀,充分反应后滤去沉淀物,再向滤液中加入过量的AgNO3溶液,最后得到卤化银沉淀15.46g为AgBr、AgCl,根据质量守恒可知,Ag元素的质量为15.46g-4.66g=10.8g,故其物质的量为$\frac{10.8g}{108g/mol}$=0.1mol,根据Ag元素守恒,参加反应n(AgNO3)=n(Ag元素)=0.1mol,
由Ag守恒可知AgBr、AgCl总物质的量为0.1mol,设AgBr、AgCl的物质的量分别为a mol、b mol,则:
$\left\{\begin{array}{l}{a+b=0.1}\\{188a+143.5b=15.46}\end{array}\right.$
解得a=0.025,b=0.075,
根据Br元素守恒,n(BrClx)=n(AgBr)=0.025mol,
根据Cl元素守恒,则0.025mol×x=0.075mol,故x=3,
答:(1)SO2与BrClx溶液发生反应的化学方程式为:(2x+2)H2O+(x+1)SO2+2BrClx=(x+1)H2SO4+2HBr+2xHCl;
(2)BrClx中x的值为3.
点评 本题考查混合物计算,注意利用质量守恒定律确定卤化银中Ag元素质量,再利用元素守恒计算计算解答,难度中等,侧重考查学生的分析计算能力.

 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案| A. | 常温常压下,11.2L NH3所含的原子数为2NA | |
| B. | 常温常压下,80g SO3含有的氧原子数为3NA | |
| C. | 标准状况下,22.4L H2中所含原子数为NA | |
| D. | 1 mol HCl气体中的粒子数与0.5 mol/L盐酸中溶质粒子数相等 |
| A. | NaAlO2溶液中加入过量氨水 | |
| B. | Al 2(SO 4) 3溶液中加入过量KOH溶液 | |
| C. | FeCl2溶液中加入过量氨水 | |
| D. | MgSO4溶液中加入过量KOH溶液 |
| A. | 碳原子和镁原子 | B. | 硼原子和氦原子 | C. | 氯原子和碳原子 | D. | 铍原子和氧原子 |
| A. | 日常生活中常用95%的乙醇溶液来杀菌消毒,其实就是使蛋白质变性 | |
| B. | 可用淀粉溶液来检测食盐中是否含碘 | |
| C. | 误食重金属盐引起人体中毒,可喝牛奶或豆浆解毒 | |
| D. | 人应该多吃蔬菜,因为蔬菜中纤维素在人体内可水解为葡萄糖,为人提供营养 |
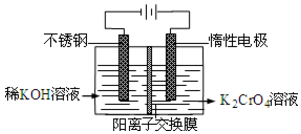 以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:下列说法不正确的是( )
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:下列说法不正确的是( )| A. | 在阴极式,发生的电极反应为:2H2O+2e-=2OH-+H2↑ | |
| B. | 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+?Cr2O72-+H2O向右移动 | |
| C. | 该制备过程总反应的化学方程式为:4K2CrO4+4H2O$\frac{\underline{\;通电\;}}{\;}$2K2Cr2O7+4KOH+2H2↑+2O2↑ | |
| D. | 测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为α=$\frac{d}{2}$ |