题目内容
 X、Y、Z是前四周期的三种元素,X原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1,元素Y原子桉外的M层中只有两对成对电子,元素Z的L层p轨道中有4个电子.
X、Y、Z是前四周期的三种元素,X原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1,元素Y原子桉外的M层中只有两对成对电子,元素Z的L层p轨道中有4个电子.(1)X的基态原子棱外电于排布式是
(2)在Y的氢化物(H2Y )分子中,Y原子轨道的杂化类型是
(3)Y与Z可形成YZ42-.
①YZ42-的空间构型为
②写出一种与YZ42- 互为等电子体的分子的化学式:.
(4)[X(NH3)4]Cl2的氯化物与氨水反应可形成配合物,1mol该配合物中含有 σ键的数目为
(5)x与Y所形成化合物晶体的晶胞如图所示.已知该晶体密度为ag.cm-3,NA表示阿伏加德罗 常数,则该晶胞体积为
考点:晶胞的计算,原子核外电子排布,元素电离能、电负性的含义及应用,原子轨道杂化方式及杂化类型判断
专题:
分析:X、Y、Z是前四周期的三种元素,X原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1,则X的最外层有2个电子,所以X的d轨道中的电子数为10,则X的核外电子排布为1s22s22p63s23p63d104s2,X为30号锌元素;元素Y原子核外的M层中只有两对成对电子,则Y的核外电子排布为1s22s22p63s23p4,所以Y为硫元素,元素Z的L层p轨道中有4个电子,则Z的核外电子排布为1s22s22p4,所以Z为氧元素,
(1)根据上面的分析可知电子排布式,根据元素周期律判断第一电离能大小;
(2)根据Y的价层电子对数判断杂化方式;
(3)根据硫原子的价层电子对数及孤电子对数判断空间构型,根据等电子体的概念写等电子体;
(4)每个共价键中都有一个σ键,据此判断;
(5)根据V=
计算.
(1)根据上面的分析可知电子排布式,根据元素周期律判断第一电离能大小;
(2)根据Y的价层电子对数判断杂化方式;
(3)根据硫原子的价层电子对数及孤电子对数判断空间构型,根据等电子体的概念写等电子体;
(4)每个共价键中都有一个σ键,据此判断;
(5)根据V=
| m |
| ρ |
解答:
解:X、Y、Z是前四周期的三种元素,X原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1,则X的最外层有2个电子,所以X的d轨道中的电子数为10,则X的核外电子排布为1s22s22p63s23p63d104s2,X为30号锌元素;元素Y原子核外的M层中只有两对成对电子,则Y的核外电子排布为1s22s22p63s23p4,所以Y为硫元素,元素Z的L层p轨道中有4个电子,则Z的核外电子排布为1s22s22p4,所以Z为氧元素,
(1)根据上面的分析可知,X的基态原子棱外电于排布式是1s22s22p63s23p63d104s2,Y为硫,Z为氧,根据元素周期律可知,两种元素第一电离能从大到小的顺序是O>S,
故答案为:1s22s22p63s23p63d104s2;O>S;
(2)在H2S分子中,S原子的价层电子对数为
=4,所以S原子的轨道的杂化类型是sp3,故答案为:sp3;
(3)①因为在SO42-中,硫原子的价层电子对数为
=4,硫原子周围没有孤电子对,所以SO42-的空间构型为正四面体,故答案为:正四面体;
②根据等电子体原理,与SO42-互为等电子体的分子的化学式为SCl4或SiCl4,故答案为:SCl4或SiCl4;
(4)在配合物[Zn(NH3)4]Cl2中,氨分子与锌离子之间有4个σ键,每个氨分子中含有3个σ键,所以一个配合物离子中含有16个σ键,所以1mol该配合物中含有16NA或6×6.02×1023个σ键,
故答案为:16NA或6×6.02×1023;
(5)根据Zn与S所形成化合物晶体的晶胞可知,每个晶胞中含有锌离子数为8×
+6×
=4,硫离子数为4,根据V=
可知,该晶胞体积为
cm3=
cm3,故答案为:
.
(1)根据上面的分析可知,X的基态原子棱外电于排布式是1s22s22p63s23p63d104s2,Y为硫,Z为氧,根据元素周期律可知,两种元素第一电离能从大到小的顺序是O>S,
故答案为:1s22s22p63s23p63d104s2;O>S;
(2)在H2S分子中,S原子的价层电子对数为
| 6+2 |
| 2 |
(3)①因为在SO42-中,硫原子的价层电子对数为
| 6+2 |
| 2 |
②根据等电子体原理,与SO42-互为等电子体的分子的化学式为SCl4或SiCl4,故答案为:SCl4或SiCl4;
(4)在配合物[Zn(NH3)4]Cl2中,氨分子与锌离子之间有4个σ键,每个氨分子中含有3个σ键,所以一个配合物离子中含有16个σ键,所以1mol该配合物中含有16NA或6×6.02×1023个σ键,
故答案为:16NA或6×6.02×1023;
(5)根据Zn与S所形成化合物晶体的晶胞可知,每个晶胞中含有锌离子数为8×
| 1 |
| 8 |
| 1 |
| 2 |
| m |
| ρ |
| ||
| a |
| 388 |
| aNA |
| 388 |
| aNA |
点评:本题考查元素的推断以及分子杂化方式、离子空间构型、第一电离能大小比较、核外电子排布、晶胞的计算等,综合性较强,难度中等,注意物质结构的基础知识的灵活运用.

练习册系列答案
相关题目
在等物质的量的短周期金属元素单质A和B中,分别加入足量的酸,在A中加入盐酸,B中加入稀硫酸,反应完全后,生成氢气的体积分别为V(A)和V(B),且V(A)≠V(B),若要确定反应生成物中A和B的化合价,至少还需知道的数据是( )
| A、V(A):V(B)的值 |
| B、V(A)(或V(B))的值 |
| C、A(或B)的物质的量 |
| D、盐酸和硫酸的物质的量浓度 |
甲、乙是由同主族元素R、Z组成的两种单质,常温下能进行如下反应:甲+乙+H2O--HRO3+HZ(未配平).下列说法正确的是( )
| A、R原子最外层电子数为5 |
| B、单质的氧化性:甲>乙 |
| C、原子半径:R>Z |
| D、HRO3与HZ的计量数比为5:1 |
下列说法正确的是( )
| A、过滤时,滤纸的边缘要高于漏斗的边缘,防止液体从滤纸和漏斗壁之间流下 |
| B、所有使用到胶头滴管的操作中,胶头滴管必须垂直悬空,离仪器口1-2cm |
| C、氢氧化钠浓溶液溅入眼中,应立即用大量水冲洗 |
| D、可用磨口玻璃塞保存NaOH、Na2CO3等碱性溶液,棕色瓶保存浓硝酸 |
下列物质中能用作萃取剂萃取溴水中溴的是( )
| A、直馏汽油 | B、裂化汽油 |
| C、酒精 | D、己烯 |
化学在工农业生产和日常生活中有着重要的应用.下列叙述正确的是( )
| A、雾霾天气对人的健康造成危害,“雾”和“霾”的分散质微粒相同 |
| B、“辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 |
| C、浸泡过高锰酸钾溶液的硅土可用于鲜花和水果的保鲜 |
| D、“84”消毒液和洁厕灵可以混合使用,以达到更好的去污效果 |
 国庆期间对大量鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,说法正确的是( )
国庆期间对大量鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,说法正确的是( )| A、分子式C15H21O4 |
| B、既能发生加聚反应,又能发生缩聚反应 |
| C、分子中有两个手性碳原子 |
| D、既能使氯化铁溶液发生显色反应,又能使酸性高锰酸钾溶液褪色 |
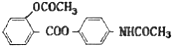 ,其合成途径如下:
,其合成途径如下: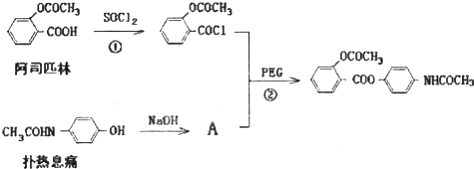 完成下列填空:
完成下列填空: