题目内容
3.现在工业上主要采用离子交换膜法(图1)电解饱和食盐水制取NaOH、H2和Cl2.阳离子交换膜有一种特殊的性质,即它只允许阳离子通过,而阻止阴离子和气体通过.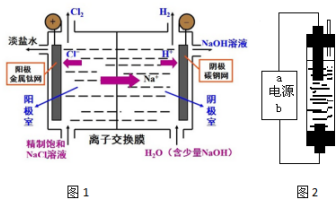
请回答下列问题:
(1)电解之前,食盐水需要精制,目的是除去粗盐中的Ca2+、Mg2+、SO42-等杂质离子,使用的试剂有:
a.Na2CO3溶液,b.Ba(OH)2溶液,c.稀盐酸.
其合理的加入顺序为(填试剂序号)bac.
(2)在电解过程中,对水的电离是促进的(填“促进”或“抑制”或“没有影响”);与电源正极相连的电极上所发生的电极反应式为2Cl--2e-→Cl2↑.
(3)如果在容积为10L的离子交换膜电解槽中,1min后在阴极可产生11.2L(标准状况)H2,这时溶液的pH值是升高(填“升高”、“降低”或“不变”),溶液中c(OH-)为(设体积保持不变)0.1mol/L.
(4)若没有阳离子交换膜的存在,改用图2电解发生器(b为电源正极,用石墨作电极),可制备家用环保型消毒液(NaClO溶液).则此实验时电解饱和食盐水的总化学方程式是NaCl+H2O$\frac{\underline{\;通电\;}}{\;}$NaClO+H2↑.
(5)室温条件下,该消毒液(NaClO)溶液的pH>7,原因是ClO-+H2O?HClO+OH-(用离子方程式表示).
分析 (1)盐酸要放在最后,来除去过量的氢氧化钠和碳酸钠,要先加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除过量的钡离子;
(2)电解NaCl溶液时,水电离出来的氢离子在阴极反应,阳极上氯离子放电生成氯气;
(3)阴极电极反应式为 2H++2e-→H2↑,生成11.2L氢气消耗1mol氢离子,溶液中生成1mol氢氧根离子,据此分析;
(4)若采用无隔膜电解食盐水,Cl2和NaOH充分接触,产物仅是NaClO和H2,则阳极上氯离子放电生成次氯酸钠、阴极上氢离子放电,据此分析解答;
(5)NaClO是弱酸强碱盐,其水解导致溶液显碱性.
解答 解:(1)要先除硫酸根离子,然后再除钙离子,Na2CO3可以除去过量的钡离子,否则过量的钡离子不能完全除尽,至于加NaOH除去镁离子顺序不受限制,可放在加入BaCl2之前或之后,因为过量的NaOH加HCl就可以调节了,只要将三种离子完全除去,过滤即可,最后加HCl除去过量的氢氧根离子碳酸根离子,故答案为:bac;(2)电解NaCl溶液时,水电离出来的氢离子在阴极反应,促进了水的电离,阳极上氯离子放电生成氯气,电极反应式为 2Cl--2e-→Cl2↑,
故答案为:促进; 2Cl--2e-→Cl2↑;
(3)阴极电极反应式为 2H++2e-→H2↑,生成11.2L氢气即0.5mol氢气,消耗1mol氢离子,溶液中生成1mol氢氧根离子,所以pH升高,c(OH-)=$\frac{1mol}{10L}$=0.1mol/L,
故答案为:升高;0.1mol/L;
(4)若采用无隔膜电解食盐水,Cl2和NaOH充分接触,产物仅是NaClO和H2,则阳极上氯离子放电生成次氯酸钠、阴极上氢离子放电,电池反应式为NaCl+H2O$\frac{\underline{\;通电\;}}{\;}$NaClO+H2↑,故答案为:NaCl+H2O$\frac{\underline{\;通电\;}}{\;}$NaClO+H2↑;
(5)NaClO是弱酸强碱盐,其水解导致溶液显碱性,水解方程式为ClO-+H2O?HClO+OH-,故答案为:ClO-+H2O?HClO+OH-.
点评 本题考查原电池和电解池原理、电极反应式的书写、盐类水解,明确电极上得失电子及反应物质是解本题关键,电极反应式的书写是学习难点,要注意结合电解质溶液的酸碱性书写,难度中等.

| A. | O2与O5 | |
| B. | 1H和2H | |
| C. | 淀粉和纤维素 | |
| D. | CH3-CH2-CH2-CH3与 CH3-CH (CH3)-CH3 |
| 选项 | 实验描述 |
| A | 将SO2通入到紫色石蕊溶液中,溶液先变红后褪色 |
| B | 将SO2通入到KMnO4(H+)溶液中,紫色褪去 |
| C | 将Cl2与SO2 按物质的量之比1:1混合后,通入到品红溶液中,红色褪去 |
| D | 将CO2通入BaCl2溶液,出现白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 氟化氢 | B. | 水 | C. | 硅化氢 | D. | 二氧化碳 |

| A. | 锌电极是正电极 | B. | 锌电极得到电子 | ||
| C. | 铜电极上有氢气产生 | D. | 铜电极上发生氧化反应 |
| A. | C3H5O | B. | C2H8N2 | C. | C2H8 | D. | C2H5N |
| A. | 酸性氧化物一定是非金属氧化物 | B. | 碱性氧化物一定是金属氧化物 | ||
| C. | 氧气和臭氧是氧元素的不同核素 | D. | H2 D2 T2 互为同位素 |

| A. | 正反应为吸热反应 | |
| B. | 加人催化剂,该化学反应的反应热改变 | |
| C. | 反应物总能量高于生成物总总量 | |
| D. | 升高温度可增大正反应速率,降低逆反应速率 |
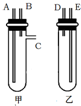 某兴趣小组要进行有关氢气的定量测定实验,为保证氢气不损失,设计用甲、乙两装置及橡胶管完成锌粒和稀硫酸制取氢气的操作.步骤如下:
某兴趣小组要进行有关氢气的定量测定实验,为保证氢气不损失,设计用甲、乙两装置及橡胶管完成锌粒和稀硫酸制取氢气的操作.步骤如下: