题目内容
12.仔细分析如图装置,完成下面的填空:
(1)该反应的电流方向是铜极流向锌极.
(2)盐桥中的阴离子向ZnSO4溶液中移动.
(3)一段时间后,锌片上的现象是逐渐溶解,铜片上的现象是产生气泡.
(4)锌极发生氧化反应,总反应方程式为Zn-2e-=Zn2+.
(5)30min后,1.3g的Zn参加了反应,则转移了0.24×1023个电子.
分析 该装置为原电池原理,锌做负极,锌逐渐溶解,发生氧化反应,铜棒为正极,发生还原反应生成氢气,电流有正极流向负极,阴离子向负极移动,根据电极方程式及得失电子守恒计算,以此解答该题.
解答 解:该装置为原电池原理,锌做负极,锌逐渐溶解,发生氧化反应,铜棒为正极,发生还原反应生成氢气,电流有正极流向负极,阴离子向负极移动
(1)根据上述分析,Zn为原电池负极,铜为正极,电流由正极流向负极,及由铜极流向锌极,
故答案为:铜极流向锌极;
(2)原电池中阴离子向负极移动,故盐桥中阴离子向硫酸锌溶液中流动,
故答案为:ZnSO4;
(3)锌做负极,锌逐渐溶解,发生氧化反应,铜棒为正极,发生还原反应生成氢气,产生气泡,
故答案为:逐渐溶解;产生气泡;
(4)锌做负极,锌逐渐溶解,发生氧化反应,电极方程式为Zn-2e-=Zn2+,
故答案为:氧化;Zn-2e-=Zn2+;
(5)根据电极反应Zn-2e-=Zn2+,当有2mol电子转移,溶解65g锌,1.3g的Zn为0.02mol,此时转移0.04mol,转移0.24×1023个电子,
故答案为:0.24×1023.
点评 本题考查原电池知识,为高考常见题型,侧重于学生的分析能力的考查,注意把握原电池的工作原理,把握电极方程式的书写,难度不大.

练习册系列答案
相关题目
2.BHT是一种常用的食品抗氧化剂,从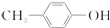 出发合成BHT的方法有如下两种.下列说法不正确的是( )
出发合成BHT的方法有如下两种.下列说法不正确的是( )
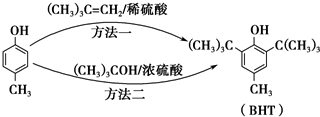
 出发合成BHT的方法有如下两种.下列说法不正确的是( )
出发合成BHT的方法有如下两种.下列说法不正确的是( )
| A. | 推测BHT在水中的溶解度小于苯酚 | |
| B. | 方法一和方法二的反应类型都是加成反应 | |
| C. | BHT与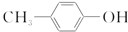 都能使酸性KMnO4褪色 都能使酸性KMnO4褪色 | |
| D. | BHT与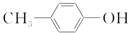 具有完全相同的官能团 具有完全相同的官能团 |
3.2005年6月5日我国环境日主题是“人人参与,创建绿色家园”.下列说法不正确的是( )
| A. | 回收废旧电池 | |
| B. | 加强控制燃放烟花爆竹法规 | |
| C. | 停止使用含铅汽油 | |
| D. | 将工厂烟囱加高,减少周围大气污染 |
20.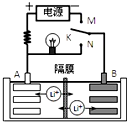 如图是一种可充电的锂离子电池充、放电的工作示意图.该电池的反应式为:
如图是一种可充电的锂离子电池充、放电的工作示意图.该电池的反应式为:
LiMnO2+C6$?_{放电}^{充电}$Li1-xMnO2+LixC6(LixC6表示锂原子嵌入石墨形成的复合材料),下列有关说法正确的是( )
 如图是一种可充电的锂离子电池充、放电的工作示意图.该电池的反应式为:
如图是一种可充电的锂离子电池充、放电的工作示意图.该电池的反应式为:LiMnO2+C6$?_{放电}^{充电}$Li1-xMnO2+LixC6(LixC6表示锂原子嵌入石墨形成的复合材料),下列有关说法正确的是( )
| A. | K与N相接时,A极为负极,该电极反应式为:LixC6-xeˉ=C6+xLi+ | |
| B. | 该电池的比能量与用单质锂作电极的锂电池的比能量相同 | |
| C. | K与M相接时,A极发生氧化反应,LiMnO2-xeˉ=Li1-xMnO2+xLi+ | |
| D. | K与N相接时,Li+由A极区迁移到B极区 |
17.充分燃烧1mol气态烃R,得到标准状况下44.8LCO2和54gH2O,则R是( )
| A. | C2H6 | B. | C2H4 | C. | C2H2 | D. | C4H6 |
12.下列关于有机物的说法正确的是( )
| A. | 甲苯和硝基苯均属于芳香烃 | |
| B. | 石油和天然气的主要成分都是碳氢化合物 | |
| C. | CH2=CHBr和CH3COCl 均属于卤代烃 | |
| D. | 分子内含有苯环和羟基的化合物都属于酚类 |
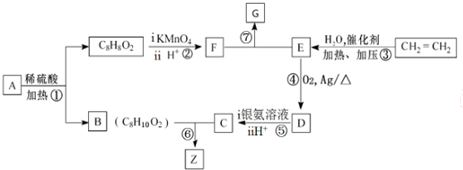
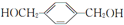 ,其所含官能团名称为羟基.
,其所含官能团名称为羟基. .
.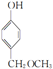 ,
,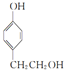 ,
,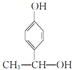 ,
,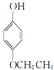 .
.