题目内容
下列对有关实验事实的解释正确的是
A.向某溶液中滴加氯水后,再加入KSCN溶液,溶液呈红色,说明原溶液中含有Fe2+
B.浓硫酸和浓盐酸长期暴露在空气中浓度均降低,原理不相同
C.向某溶液中加入氯化钡溶液,生成白色沉淀,再加入稀盐酸,沉淀不溶解,则原溶液一定含有SO42
D.常温下,浓硫酸可以用铁质容器储运,说明铁与冷的浓硫酸不反应
B
【解析】
试题分析:A.向某溶液中滴加氯水后,再加入KSCN溶液,溶液呈红色,由于原溶液中含有铁离子,也能与KSCN溶液反应显红色,因此不能说明原溶液中含有Fe2+,A错误;B.浓硫酸和浓盐酸长期暴露在空气中浓度均降低,原理不相同,前者是吸水,后者是挥发,B正确;C.向某溶液中加入氯化钡溶液,生成白色沉淀,再加入稀盐酸,沉淀不溶解,该沉淀可能是氯化银或硫酸钡,因此原溶液不一定含有SO42,C错误;D.常温下,浓硫酸可以用铁质容器储运,是因为铁发生钝化,但钝化是化学变化,铁与冷的浓硫酸反应,D错误,答案选B。
考点:考查离子检验、浓硫酸、浓盐酸的性质判断

 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案下列根据实验操作和现象所得出的结论正确的是
| 实验操作 | 实验现象 | 结论 |
A | 淀粉与稀H2SO4共热,再加银 氨溶液水浴加热 | 无银镜生成 | 淀粉水解产物无还原性 |
B | 向某溶液中先滴加氯水,再滴 加少量KSCN溶液 | 溶液变成血红色 | 溶液中含有Fe2+ |
C | 向NaAlO2溶液中滴加饱和NaHCO3溶液 | 有白色沉淀产生 | 验证两者都发生了水解反应,且相互促进 |
D | 将CO2通入Na2SiO3溶液中 | 有白色沉淀生成 | 证明H2CO3酸性比H2SiO3强 |
(16分)活性氧化锌在橡胶、化工、涂料、陶瓷、医药、电子等行业有着广泛的应用。但随着锌资源的不断开发和利用,锌矿资源越来越少,因此研究利用锌二次资源对缓解锌资源枯竭进程具有重要意义。下图是以含锌铜烟尘(火法炼铜的副产品,主要成分是ZnO、CuO和FeO)制备活性氧化锌的工艺流程:
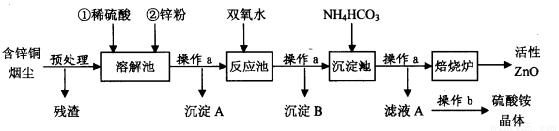
含锌铜烟尘经过预处理后的主要成分为ZnO,还含有少量的CuO和Fe2O3。
(1)操作a名称是____ ,在实验室中,该过程用到的主要玻璃仪器有 。
(2)溶解池中待固体全部溶解后,加入锌粉的作用有:
①将Fe3+还原为Fe2+;② :③调节溶液的pH(控制其在5,0-5.4之间)。
(3)检验溶解池中Fe3+已全部被还原为Fe2+的最佳试剂是 ;
(4)右表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为
1.0 mol-l计算)。反应池中的温度控制在90-95℃,请写出反应池中所发生反应的离子方
程式: 。
| 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
2n2+ | 5.9 | 8.9 |
(5)操作b的名称是________ ;
(6)沉淀池中得到的沉淀化学式可以表示为:aZnCO3·bZn(OH)2·cH2O(a、b、c均为整数)。某校化学兴趣小组的同学为了确定其组成,进行如下实验:称取3.59g沉淀进行焙烧,将焙烧过程中产生的气体依次通过足量的浓硫酸和碱石灰,它们分别增重0.72g和0.44g,则该沉淀的组成为 。
 >
>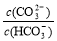

 N
N  K
K