题目内容
(15分)下列框图所示的转化关系中,A、C均为常见的金属单质,A、C在冷的H的浓溶液中均会发生钝化;E为固体非金属单质。B为红色固体氧化物,X为常见的无色液体。L焰色为黄色,且能使酚酞变红(反应过程中生成的水及其他产物已略去)
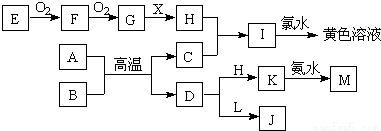
请回答以下问题:
(1)含碳量在0.03 %~2 %之间的C的合金,是目前世界上使用量最大的合金,这种合金是 ;
A.铝合金 B.青铜 C.镁合金 D.钢铁
(2)F的化学式为 ;
(3)I与氯气反应的离子方程式为 ;
(4)A与B生成C和D的反应是 (填“放出”或“吸收”)大量热量的反应;
(5)D与L反应的离子方程式为 。
(1)D (3分) (2)SO2 (3分) (3)2Fe2+ + Cl2 = 2Fe3+ + 2Cl? (3分)
(4)放出 (3分) (5)Al2O3 + 2OH—=2AlO2— + H2O (3分)
【解析】
试题分析:A、C均为常见的金属单质,A、C在冷的H的浓溶液中均会发生钝化,则A、C为Fe、Al,H可能为浓硫酸或浓硝酸,A、B之间的反应为铝热反应,由于B为红色固体氧化物,应为Fe2O3,则A为Al,C为Fe,D为A12O3。E为固体非金属单质,应为S,则F为SO2,G为SO3,H为H2SO4。X为常见无色液体,应为H2O,I为FeSO4,L焰色为黄色,且能使酚酞变红,且能与Al2O3反应,则L为NaOH,与Al2O3反应生成J,J为NaAlO2,A12O3与硫酸反应生成Al2(SO4)3,即K为Al2(SO4)3,M为Al(OH)3,则
(1)含碳量在0.04%~2.3%之间铁合金为钢,故答案为:D;
(2)根据以上分析可知F的化学式为SO2;
(3)Fe2+具有还原性,与具有强氧化性的Cl2反应生成Fe3+,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-;
(4)A、B之间的反应为铝热反应,属于放热反应;
(5)D与L的反应为Al2O3和NaOH的反应,生成NaAlO2和水,反应的离子方程式为Al2O3 + 2OH—=2AlO2— + H2O。
考点:考查无机物的推断

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
 PCl3 (g)+Cl2(g)。达到平衡时,再向容器内通入一定量PCl5 (g),重新达到平衡后,与第一次平衡时相比,Cl2的浓度
PCl3 (g)+Cl2(g)。达到平衡时,再向容器内通入一定量PCl5 (g),重新达到平衡后,与第一次平衡时相比,Cl2的浓度

 2SO3(g),△H<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是
2SO3(g),△H<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是 