题目内容
6.下列与化学概念有关的说法正确的是( )| A. | 硝酸、亚硫酸和次氯酸都是见光易分解的挥发性酸 | |
| B. | 合金属于金属单质,很多性能与组成它的纯金属不同 | |
| C. | 金属及其氧化物、氢氧化物都不可能与强碱溶液反应 | |
| D. | 元素的非金属性、金属性强弱与其得失电子数目无直接关系 |
分析 A.亚硫酸见光不易分解;
B.合金的很多性能与组成它们的纯金属不同;
C.铝能与强碱反应;
D.元素非金属性越强,原子越容易获得电子,元素原子最外层电子数多,元素的非金属性不一定强.
解答 解:A.亚硫酸见光不易分解,硝酸和次氯酸见光易分解,故A错误;
B.合金的很多性能与组成他们的纯金属不同,使合金的用途更加大广泛,合金的性能比组成它的纯金属的性能优良,故B错误;
C.铝、三氧化二铝、氢氧化铝能与强碱反应,故C错误;
D.元素原子最外层电子数多,元素的非金属性不一定强,如I原子最外层电子数为7,O原子最外层电子数为6,非金属性O>I,故D正确.
故选D.
点评 本题侧重考查元素周期律,结构性质位置关系、非金属性比较等,难度不大,注意对基础知识的理解掌握.

练习册系列答案
相关题目
16.2015年8月12日位于天津滨海新区某一危险品仓库发生大爆炸,人员和财产损失严重.为此我们应做好各类安全预案.下列行为符合安全要求的是( )
| A. | 金属钠着火时,立即用水灭火 | |
| B. | 配制稀硫酸时将水倒入浓硫酸中 | |
| C. | 用点燃的火柴在液化气钢瓶口检验是否漏气 | |
| D. | 大量氯气泄漏时,迅速离开现场并尽量往高处走 |
17.按要求回答下列问题:
(1)实验室常用NaOH溶液来进行洗气和提纯,当100mL3mol/L的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
(2)常温下向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是CD.
A.溶液中导电粒子的数目减小
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变
D.溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(O{H}^{-})}$减小
(3)①常温下将0.15mol/L稀硫酸V1mL与0.1mol/LNaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2=1:1(溶液体积变化忽略不计).
②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法正确的是AD
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7 mol/L
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(4)常温下,浓度均为0.1mol/L的下列五种溶液的pH值如表所示:
①根据表中数据,将浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是A.
A.HCN B.HClO C.Na2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是AB.
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+2NaClO═Na2CO3+2HClO
D.NaHCO3+HCN═NaCN+CO2+H2O
(5)几种离子开始沉淀时的pH如下表:
当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,Cu2+(填离子符号)先沉淀,Ksp[Fe(OH)2]<Ksp[Mg(OH)2](填“>”、“=”或“<”)
(1)实验室常用NaOH溶液来进行洗气和提纯,当100mL3mol/L的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
(2)常温下向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是CD.
A.溶液中导电粒子的数目减小
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变
D.溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(O{H}^{-})}$减小
(3)①常温下将0.15mol/L稀硫酸V1mL与0.1mol/LNaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2=1:1(溶液体积变化忽略不计).
②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法正确的是AD
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7 mol/L
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(4)常温下,浓度均为0.1mol/L的下列五种溶液的pH值如表所示:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A.HCN B.HClO C.Na2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是AB.
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+2NaClO═Na2CO3+2HClO
D.NaHCO3+HCN═NaCN+CO2+H2O
(5)几种离子开始沉淀时的pH如下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
1.下列说法中不正确的是( )
| A. | 含SO2的烟气可用石灰乳吸收后再排放,以减少对空气污染 | |
| B. | 汽车尾气、工业排放、建筑扬尘、垃圾焚烧等都是造成雾霾天气的主要原因 | |
| C. | 绿色化学的核心是对环境产生的污染进行治理 | |
| D. | PM2.5由于颗粒小,在空气中存在时间长,对人体健康危害大 |
11.下列实验的有关叙述错误的是( )
| 选项 | A | B | C | D |
| 实验装置图 |  |  |  |  |
| 实验现象 | 乙装置中有亮光通路,甲装置无明显现象 | 关闭止水夹,捂住圆底烧瓶,导管中水柱上升后静止不动 | 打开止水夹,挤压胶头滴管中的水,有喷泉产生 | 电流表指针发生偏转 |
| 实验结论 | 甲装置中分散系不是胶体,乙装置中分散系为胶体 | 该装置气密性良好 | HCl易溶于水 | 电子从铝箔流出,经电流表、活性炭、滤纸回到铝箔 |
| A. | A | B. | B | C. | C | D. | D |
18.某无色透明的溶液中,能大量共存的离子组是( )
| A. | Na+、Cu2+、SO42-、OH- | B. | K+、Ba2+、Cl-、NO3- | ||
| C. | K+、Ca2+、Cl-、MnO4- | D. | Na+、CO32-、SO42-、H+ |
15.把少量废铁屑溶于过量的稀硫酸中,过滤,除去杂质,在滤液中加入适量的硝酸,再加入过量的氨水,有红褐色沉淀生成.过滤,加热至沉淀物质量不再变化,得到红棕色的残渣.上述沉淀和残渣分别为( )
| A. | Fe(OH)3;Fe2O3 | B. | Fe(OH)2;FeO | ||
| C. | Fe(OH)3Fe(OH)2;Fe2O3 | D. | Fe2O3;Fe(OH)3 |
 金属及其化合物在化学中扮演着重要的角色,同学们应该熟练掌握它们的性质.
金属及其化合物在化学中扮演着重要的角色,同学们应该熟练掌握它们的性质.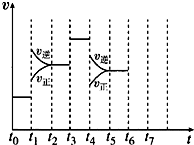 在一密闭容器中发生反应N2+3H2?2NH3,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
在一密闭容器中发生反应N2+3H2?2NH3,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示: