题目内容
9.CO2可转化成有机物实现碳循环.(1)在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0mol•L-1,测得CO2和CH3OH(g)的浓度随时间变化如图1所示.

①从0min到10min,v(H2)=0.225mol•(L•min)-1.
②能说明上述反应达到平衡状态的是BD(选填编号).
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.容器内气体的压强不随时间的变化而变化
C.单位时间内每消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
③下列措施中能使n (CH3OH)/n (CO2)增大的是AD(选填编号).
A.将H2O(g)从体系中分离B.恒温恒容充入He
C.恒温恒压充入HeD.恒温恒容再充入1mol CO2和3mol H2
(2)据报道,一定条件下由二氧化碳和氢气合成二甲醚已成为现实.
2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)在一定压强下,测得反应的实验数据如表.
 | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
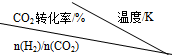
①反应的温度升高,K值减小(填“增大”、“减小”或“不变”).
②提高氢碳比[n(H2)/n(CO2)],K值不变(填“增大”、“减小”或“不变”).
(3)800℃时,C(s)+CO2(g)?2CO(g)的平衡常数K=1.64,相同条件下测得c(CO)=0.20mol•L-1、c(CO2)=0.05mol•L-1,此时反应向正(填“正”或“逆”)方向进行.
(4)在密闭容器中通入1mol H2和1mol CO2发生H2(g)+CO2(g)?CO(g)+H2O(g)△H>0反应,当反应达到平衡后,在其他条件不变时,若升高温度,请在图中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图2.
分析 (1)①根据v=$\frac{△c}{△t}$计算v(CH3OH),再利用速率之比等于化学计量数之比计算v(H2);
②可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡;
③A.将H2O(g)从体系中分离,平衡正向移动;
B.恒温恒容充入He,平衡不移动;
C.恒温恒压充入He,容器体积增大,反应混合物浓度减小,分压减小,平衡逆向移动;
D.恒温恒容再充入1mol CO2和3mol H2,等效为增大压强,平衡逆向移动;
(2)①$\frac{n({H}_{2})}{n(C{O}_{2})}$一定时,升高温度,二氧化碳转化率减小,说明升高温度平衡正向移动;
②平衡常数只受温度影响;
(3)计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行;
(4)当反应达到平衡后,在其他条件不变时,若升高温度,改变条件瞬间正逆反应速率都增大,正反应为吸热反应,平衡时正向移动,瞬间正反应速率增大更多,然后正反应速率减小,逆反应速率增大,到达新平衡时正逆速率又相等.
解答 解:(1)①10min内生成甲醇为0.75mol,则v(CH3OH)=$\frac{\frac{0.75mol}{1L}}{10min}$=0.075mol/(L.min),速率之比等于化学计量数之比,则v(H2)=3v(CH3OH)=0.225mol/(L.min),
故答案为:0.225;
②A.图中交叉点后甲醇物质的量继续增大到不变,二氧化碳物质的量继续减小到不变,说明交叉点未到达平衡,反应向正反应进行,故A错误;
B.随反应进行混合气体总物质的量减小,恒温恒容下容器内压强减小,容器内气体的压强不随时间的变化而变化说明到达平衡,故B正确;
C.单位时间内每消耗3mol H2,同时生成1mol H2O,均表示正反应速率,反应始终按该比例关系进行,故C错误;
D.CO2的体积分数在混合气体中保持不变,说明到达平衡,故D正确,
故选:BD;
③A.将H2O(g)从体系中分离,平衡正向移动,n (CH3OH)/n (CO2)增大,故A正确;
B.恒温恒容充入He,平衡不移动,n (CH3OH)/n (CO2)不变,故B错误;
C.恒温恒压充入He,容器体积增大,反应混合物浓度减小,分压减小,平衡逆向移动,n (CH3OH)/n (CO2)减小,故C错误;
D.恒温恒容再充入1mol CO2和3mol H2,等效为增大压强,平衡正向移动,n (CH3OH)/n (CO2)增大,故D正确;
故选:AD;
(2)①$\frac{n({H}_{2})}{n(C{O}_{2})}$一定时,升高温度,二氧化碳转化率减小,说明升高温度平衡逆向移动,故平衡常数K减小,故答案为:减小;
②平衡常数只受温度影响,与投料比无关,温度不变,平衡常数不变,故答案为:不变;
(3)此时浓度商Qc=$\frac{0.{2}^{2}}{0.05}$=0.8<K=1.64,反应向正反应进行,故答案为:正;
(4)当反应达到平衡后,在其他条件不变时,若升高温度,改变条件瞬间正逆反应速率都增大,正反应为吸热反应,平衡时正向移动,瞬间正反应速率增大更多,然后正反应速率减小,逆反应速率增大,到达新平衡时正逆速率又相等,正(v正)、逆(v逆)反应速率随时间t变化图为: ,
,
故答案为: .
.
点评 本题考查化学平衡计算与影响因素、反应速率计算、平衡常数、平衡状态判断与建立等,是对学生综合能力的考查,难度中等.

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
下列推断中正确的是( )
| A. | 步骤①和②中的气体属于可循环使用的气体 | |
| B. | 步骤②中发生的反应为:Ca2++CO2+2NH3•H2O═CaCO3↓+2NH4++H2O | |
| C. | 往甲中通CO2有利于(NH4)2SO4生成 | |
| D. | 以上涉及的化学反应中有氧化还原反应 |
 实验室合成溴苯的装置图及有关数据如下,按下列合成步骤回答:
实验室合成溴苯的装置图及有关数据如下,按下列合成步骤回答:| 苯 | 溴 | 溴苯 | |
| 密度/g.cm3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(2)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白雾产生,是因为生成了HBr气体.继续滴加至液溴滴完.写出a中发生反应的化学方程式:2Fe+3Br2═2FeBr3
 .
.(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入无水氯化钙的目的是干燥.
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,需进行的操作方法为蒸馏.

| A. | 点a处的正反应速率比点b处的大 | |
| B. | 点c处的正反应速率与逆反应速率相等 | |
| C. | 点d(t1时刻)的n(N2)比点e(t2时刻)处的n(N2)大 | |
| D. | 其他条件不变,773K下反应至t1时刻,此时画出的两根平行线间的距离将要变小 |
| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙 醇 | -117.0 | 78.0 | 0.79 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | -- | 338.0 | 1.84 |
①在30mL的大试管A中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合溶液.
②按图1连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10min.

③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层.
④分离出乙酸乙酯层、洗涤、干燥.
请根据题目要求回答下列问题:
(1)配制该混合溶液的主要操作步骤为在一个30mL大试管中注入4mL乙醇,再分别缓缓加入4mL乙酸、1mL浓硫酸(乙酸和浓硫酸的加入顺序可互换),边加边振荡试管使之混合均匀;
写出制取乙酸乙酯的化学方程式CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O
(2)上述实验中饱和碳酸钠溶液的作用是(填字母):BC
A.中和乙酸和乙醇.
B.中和乙酸并吸收部分乙醇.
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出.
D.加速酯的生成,提高其产率.
(3)步骤②中需要小火均匀加热操作,其主要理由是:因为反应物乙醇、乙酸的沸点较低,若用大火加热,反应物大量随产物蒸发而损失原料,温度过高可能发生其它副反应.
(4)指出步骤③所观察到的现象:试管B中的液体分成上下两层,上层无色,下层为红色液体,振荡后下层液体的红色变浅
(5)某化学课外小组设计了如图2所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与图1装置相比,图2装置的主要优点有:(答两点)
①增加了温度计,便于控制发生装置中反应液的温度,减少副产物的发生
②增加了分液漏斗,有利于及时补充反应混合液,以提高乙酸乙酯的产量,或增加了冷凝装置,有利于收集产物乙酸乙酯.
| A. | 1molH2 | B. | 2 molNa2CO3 | C. | 0.5mol氧 | D. | 2 molOH- |
 实验室用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
实验室用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:有关数据列表:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -116 |
(1)写出实验室制乙烯的反应方程式C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(2)在此实验中,装置A要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在此实验中,装置A中要加些沸石,原因是防止液体瀑沸;
(4)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.CCl4
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(6)若生成的产物中有少量未反应的Br2,最好用b洗涤除去;(填正确选项前的母)
a.水 b.氢氧化钠溶液 c.苯 d.乙醇
(7)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(8)反应过程中应用冷水冷却装置D,其主要目的是冷却,可避免溴的大量挥发.
 水的离子积常数Kw与温度t(℃)的关系如图所示:
水的离子积常数Kw与温度t(℃)的关系如图所示: