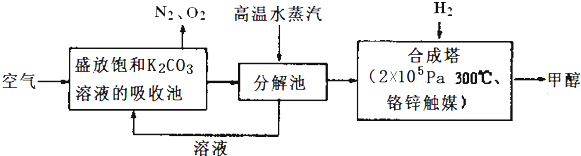
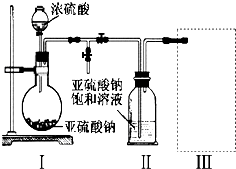
��Ŀ����
4�������ݻ������ܱ������еķ�Ӧ��N2��g��+3H2��g��?2NH3��g������H��0����673K��30MPa��n��NH3����n��H2����ʱ��仯�Ĺ�ϵ��ͼ��ʾ��������������ȷ���ǣ�������
| A�� | ��a��������Ӧ���ʱȵ�b���Ĵ� | |
| B�� | ��c��������Ӧ�������淴Ӧ������� | |
| C�� | ��d��t1ʱ�̣���n��N2���ȵ�e��t2ʱ�̣�����n��N2���� | |
| D�� | �����������䣬773K�·�Ӧ��t1ʱ�̣���ʱ����������ƽ����ľ��뽫Ҫ��С |
���� A�����ʵ�Ũ��Խ���䷴Ӧ����Խ��
B��c��������ʵ��������䣬�������ʵ�����С�����䣬��c�㷴Ӧ������Ӧ���У�
C��d��e����ͬһƽ��״̬��
D���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�������ƶ�����Ӧ��ת���ʽ��ͣ�ƽ��ʱ�������ʵ�����С����Ӧ�����ʵ�������
��� �⣺A��a���������ʵ�������b�㣬���Ե�a����Ũ�ȸ�����a������Ӧ���ʱȵ�b�Ĵ�A��ȷ��
B��c��������ʵ��������䣬�������ʵ�����С�����䣬��c�㷴Ӧ������Ӧ���У�����Ӧ���ʴ����淴Ӧ���ʣ���B����
C��d��e����ͬһƽ��״̬�����d ��t1ʱ�̣��͵�e ��t2ʱ�̣���n ��N2��һ������C����
D���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�������ƶ�����Ӧ��ת���ʽ��ͣ�ƽ��ʱ�������ʵ�����С����Ӧ�����ʵ�������ʱ����������ƽ����ľ��뽫Ҫ��С����D��ȷ��
��ѡ��BC��
���� ���⿼�黯ѧƽ��ͼ�����⣬��Ŀ�Ѷ��еȣ�ע�����ͼ���и��������ı仯���ߣ�����ƽ��״̬������Ϊ������Ĺؼ���

��ϰ��ϵ�д�
�����Ŀ
6��ij�¶�ʱ��ӦC��S��+2H2?CH4��K=8.28�������������ʵ���Ũ�ȷֱ�ΪH20.7mol/l��CH40.2mol/l ʱ��������Ӧ��������
| A�� | �����ƶ� | B�� | �����ƶ� | C�� | �ﵽƽ�� | D�� | ��һ�� |
9��CO2��ת�����л���ʵ��̼ѭ����
��1�������Ϊ1L���ܱ������У�����1mol CO2��3mol H2��һ�������·�����Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-49.0mol•L-1�����CO2��CH3OH��g����Ũ����ʱ��仯��ͼ1��ʾ��

�ٴ�0min��10min��v��H2��=0.225mol•��L•min��-1��
����˵��������Ӧ�ﵽƽ��״̬����BD��ѡ���ţ���
A����Ӧ��CO2��CH3OH�����ʵ���Ũ��֮��Ϊ1��1����ͼ�н���㣩
B�������������ѹǿ����ʱ��ı仯���仯
C����λʱ����ÿ����3mol H2��ͬʱ����1mol H2O
D��CO2����������ڻ�������б��ֲ���
�����д�ʩ����ʹn ��CH3OH��/n ��CO2���������AD��ѡ���ţ���
A����H2O��g������ϵ�з���B�����º��ݳ���He
C�����º�ѹ����HeD�����º����ٳ���1mol CO2��3mol H2
��2���ݱ�����һ���������ɶ�����̼�������ϳɶ������ѳ�Ϊ��ʵ��
2CO2��g��+6H2��g��$\stackrel{����}{?}$CH3OCH3��g��+3H2O��g����һ��ѹǿ�£���÷�Ӧ��ʵ�����������
�����������ݻش��������⣺
�ٷ�Ӧ���¶����ߣ�Kֵ��С�����������С�����䡱����
�������̼��[n��H2��/n��CO2��]��Kֵ���䣨���������С�����䡱����
��3��800��ʱ��C��s��+CO2��g��?2CO��g����ƽ�ⳣ��K=1.64����ͬ�����²��c��CO��=0.20mol•L-1��c��CO2��=0.05mol•L-1����ʱ��Ӧ��������������桱��������У�
��4�����ܱ�������ͨ��1mol H2��1mol CO2����H2��g��+CO2��g��?CO��g��+H2O��g����H��0��Ӧ������Ӧ�ﵽƽ�����������������ʱ���������¶ȣ�����ͼ�л�������v�������棨v������Ӧ������ʱ��t�仯��ʾ��ͼ2��
��1�������Ϊ1L���ܱ������У�����1mol CO2��3mol H2��һ�������·�����Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-49.0mol•L-1�����CO2��CH3OH��g����Ũ����ʱ��仯��ͼ1��ʾ��

�ٴ�0min��10min��v��H2��=0.225mol•��L•min��-1��
����˵��������Ӧ�ﵽƽ��״̬����BD��ѡ���ţ���
A����Ӧ��CO2��CH3OH�����ʵ���Ũ��֮��Ϊ1��1����ͼ�н���㣩
B�������������ѹǿ����ʱ��ı仯���仯
C����λʱ����ÿ����3mol H2��ͬʱ����1mol H2O
D��CO2����������ڻ�������б��ֲ���
�����д�ʩ����ʹn ��CH3OH��/n ��CO2���������AD��ѡ���ţ���
A����H2O��g������ϵ�з���B�����º��ݳ���He
C�����º�ѹ����HeD�����º����ٳ���1mol CO2��3mol H2
��2���ݱ�����һ���������ɶ�����̼�������ϳɶ������ѳ�Ϊ��ʵ��
2CO2��g��+6H2��g��$\stackrel{����}{?}$CH3OCH3��g��+3H2O��g����һ��ѹǿ�£���÷�Ӧ��ʵ�����������
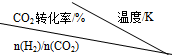 | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
�ٷ�Ӧ���¶����ߣ�Kֵ��С�����������С�����䡱����
�������̼��[n��H2��/n��CO2��]��Kֵ���䣨���������С�����䡱����
��3��800��ʱ��C��s��+CO2��g��?2CO��g����ƽ�ⳣ��K=1.64����ͬ�����²��c��CO��=0.20mol•L-1��c��CO2��=0.05mol•L-1����ʱ��Ӧ��������������桱��������У�
��4�����ܱ�������ͨ��1mol H2��1mol CO2����H2��g��+CO2��g��?CO��g��+H2O��g����H��0��Ӧ������Ӧ�ﵽƽ�����������������ʱ���������¶ȣ�����ͼ�л�������v�������棨v������Ӧ������ʱ��t�仯��ʾ��ͼ2��
16����������Ϊa%�����ʵ���Ũ��Ϊc1mol/L��ϡ��������ˮ��������������Ϊ2a%����ʱ���ʵ���Ũ��Ϊc2mol/L����c1��c2�Ĺ�ϵΪ��������
| A�� | c2=2c1 | B�� | c2��2c1 | C�� | c2��2c1 | D�� | c1=2c2 |
13�������£���H2O2��Һ�еμ�����FeSO4��Һ���ɷ�������������Ӧ��2Fe2++H2O2+2H+�T2Fe3++2H2O��2Fe3++H2O2�T2Fe2++O2��+2H+������˵���У�����ȷ���ǣ�������
| A�� | ��H2O2�ֽ�����У�Fe2+�Ƿ�Ӧ�Ĵ��� | |
| B�� | ��H2O2���������У�Ҫ�ϸ������� Fe2+ | |
| C�� | H2O2�������Ա�Fe3+ǿ����ԭ�Ա�Fe2+ǿ | |
| D�� | ��H2O2�ֽ�����У���Һ��pH���½� |