题目内容
11.下列物质能导电的是④⑦⑧,属于电解质的是①③⑤⑧,属于非电解质的是②⑥.①NaCl晶体 ②液态SO2 ③液态醋酸 ④汞 ⑤BaSO4固体 ⑥纯蔗糖(C12H22O11) ⑦氨水 ⑧熔化的KNO3.
分析 根据导电原因、电解质、化合物的定义判断.
能导电的物质必须含有自由电子或自由离子.
电解质:在水溶液里或熔融状态下能导电的化合物.该定义的前提必须是化合物.
非电解质:在水溶液里或熔融状态下都不能导电的化合物.该定义的前提必须是化合物.
解答 解:①氯化钠晶体 是电解质,但 没有自由电子或自由离子,所以不导电.
②液态SO2,是非电解质,因没有自由电子或自由离子,所以不导电.
③液态醋酸,是电解质,因没有自由电子或自由离子,所以不导电.
④汞是单质,所以既不是电解质也不是非电解质,汞中有自由电子,所以能导电;⑤盐酸是混合物,但溶液中含有自由离子,所以能导电.
⑤BaSO4固体是电解质,因没有自由电子或自由离子,所以不导电.
⑥蔗糖是非电解质,因没有自由电子或自由离子,所以不导电.
⑦氨水是混合物,因有自由离子,所以导电.
⑧熔化的KNO3是电解质,因有自由离子,所以导电.
故答案为:④⑦⑧;①③⑤⑧;②⑥.
点评 注意以下几点错误认识:
1、能导电的物质一定是电解质,如铜不是电解质但能导电.
2、电解质一定导电,如氯化钠晶体,因没有自由电子或自由离子,所以不导电.
3、不是电解质的物质就一定是非电解质,如氯气既不是电解质也不是非电解质.
4、其水溶液能导电的化合物是电解质,如二氧化硫,二氧化硫和水反应生成亚硫酸,亚硫酸电离出自由移动的离子,所以其水溶液能导电,因离子是亚硫酸电离的而不是二氧化硫电离的,所以二氧化硫是非电解质.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
1.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4LH2O含有的分子数为NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.01NA | |
| C. | 常温常压下,NA个CO2分子占有的体积为22.4L | |
| D. | 1升物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 数目为NA |
2.用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行中和反应,通过测定反应过程中所放出的热量(盐酸和氢氧化钠溶液的密度为1g/cm3,反应前后温度差为3.4℃,反应前后的比热容按4.18J•g-1•℃-1),则中和热为( )
| A. | -14.2 KJ/mol | B. | -28.4 KJ/mol | C. | -42.6 KJ/mol | D. | -56.8 KJ/mol |
19.把7.4g Na2CO3•10H2O和NaHCO3组成的混合物完全溶解于水配成100mL溶液,其中c(Na+)=0.6mol/L.向溶液中加入足量的盐酸充分反应,将溶液蒸干后,所得固体质量是( )
| A. | 2.12g | B. | 3.51g | C. | 4.22g | D. | 5.28g |
6.某温度时反应C(S)+2H2?CH4的K=8.28,当各气体物质的量浓度分别为H20.7mol/l、CH40.2mol/l 时,上述反应( )
| A. | 正向移动 | B. | 逆向移动 | C. | 达到平衡 | D. | 不一定 |
16.下列事实没有涉及可逆反应的是( )
| A. | 工业上合成氨的原理 | |
| B. | 工业上产生硫酸 | |
| C. | 热的纯碱溶液洗涤效果更好 | |
| D. | 受热时,试管底部的NH4Cl部分转移至试管上端 |
3.铝和氢氧化钠溶液反应
化学方程式:①2Al+6HCl=2AlCl3+3H2↑,②2Al+2H2O+2NaOH=2NaAlO2+3H2↑;
离子方程式:①2Al+6H+=2Al3++3H2↑,②2Al+2OH-+2H2O=2AlO2-+3H2↑.
| 实验现象 | |
| 1.向打磨过的铝片中加入稀盐酸 | |
| 2.向打磨过的铝片中加入Na0H溶液 |
离子方程式:①2Al+6H+=2Al3++3H2↑,②2Al+2OH-+2H2O=2AlO2-+3H2↑.
9.CO2可转化成有机物实现碳循环.
(1)在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0mol•L-1,测得CO2和CH3OH(g)的浓度随时间变化如图1所示.

①从0min到10min,v(H2)=0.225mol•(L•min)-1.
②能说明上述反应达到平衡状态的是BD(选填编号).
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.容器内气体的压强不随时间的变化而变化
C.单位时间内每消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
③下列措施中能使n (CH3OH)/n (CO2)增大的是AD(选填编号).
A.将H2O(g)从体系中分离B.恒温恒容充入He
C.恒温恒压充入HeD.恒温恒容再充入1mol CO2和3mol H2
(2)据报道,一定条件下由二氧化碳和氢气合成二甲醚已成为现实.
2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)在一定压强下,测得反应的实验数据如表.
分析表中数据回答下列问题:
①反应的温度升高,K值减小(填“增大”、“减小”或“不变”).
②提高氢碳比[n(H2)/n(CO2)],K值不变(填“增大”、“减小”或“不变”).
(3)800℃时,C(s)+CO2(g)?2CO(g)的平衡常数K=1.64,相同条件下测得c(CO)=0.20mol•L-1、c(CO2)=0.05mol•L-1,此时反应向正(填“正”或“逆”)方向进行.
(4)在密闭容器中通入1mol H2和1mol CO2发生H2(g)+CO2(g)?CO(g)+H2O(g)△H>0反应,当反应达到平衡后,在其他条件不变时,若升高温度,请在图中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图2.
(1)在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0mol•L-1,测得CO2和CH3OH(g)的浓度随时间变化如图1所示.

①从0min到10min,v(H2)=0.225mol•(L•min)-1.
②能说明上述反应达到平衡状态的是BD(选填编号).
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.容器内气体的压强不随时间的变化而变化
C.单位时间内每消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
③下列措施中能使n (CH3OH)/n (CO2)增大的是AD(选填编号).
A.将H2O(g)从体系中分离B.恒温恒容充入He
C.恒温恒压充入HeD.恒温恒容再充入1mol CO2和3mol H2
(2)据报道,一定条件下由二氧化碳和氢气合成二甲醚已成为现实.
2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)在一定压强下,测得反应的实验数据如表.
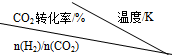 | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
①反应的温度升高,K值减小(填“增大”、“减小”或“不变”).
②提高氢碳比[n(H2)/n(CO2)],K值不变(填“增大”、“减小”或“不变”).
(3)800℃时,C(s)+CO2(g)?2CO(g)的平衡常数K=1.64,相同条件下测得c(CO)=0.20mol•L-1、c(CO2)=0.05mol•L-1,此时反应向正(填“正”或“逆”)方向进行.
(4)在密闭容器中通入1mol H2和1mol CO2发生H2(g)+CO2(g)?CO(g)+H2O(g)△H>0反应,当反应达到平衡后,在其他条件不变时,若升高温度,请在图中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图2.
 制备溴苯的实验装置如图所示,回答下列问题:
制备溴苯的实验装置如图所示,回答下列问题: )你认为该装置中可以加入苯或CCl4液体.
)你认为该装置中可以加入苯或CCl4液体.