题目内容
10.已知粗盐中含有泥沙,MgCl2,CaCl2,Na2SO4等杂质,除去杂质得到精盐用到下列操作:①溶解②过滤③蒸发④加入适量HCl溶液⑤加入过量BaCl2溶液⑥加入过量Na2CO3溶液⑦加入过量NaOH溶液
正确的操作顺序是( )
| A. | ①⑤⑥⑦②④③ | B. | ①⑤⑦⑥②④③ | C. | ①⑦⑤⑥②④③ | D. | A或B或C |
分析 根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,据此进行分析.
解答 解:加入过量NaOH溶液来除MgCl2,加过量BaCl2溶液来除Na2SO4,加过量的Na2CO3溶液来除去CaCl2和过量的BaCl2,故Na2CO3溶液的加入一定在BaCl2之后,即⑥一定在⑤之后;且一定要将生成的沉淀过滤之后再加盐酸,即④一定在②之后.
故选:D.
点评 本题主要考查了在粗盐提纯中的物质的除杂或净化操作,在解此类题时,首先要了解需要除去的是哪些离子,然后选择适当的试剂进行除杂,在除杂质时,杂质和所加的试剂的状态一样,就要注意,加入的量的控制.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列离子反应方程书写正确的是( )
| A. | H2O+H2O═H3O++OH- | |
| B. | CO32-+2H2O?H2CO3+2OH- | |
| C. | Ca(OH)2+2H+?Ca2++2H2O | |
| D. | 2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ |
18.下列说法不正确的是( )
| A. | 聚乙烯塑料制品可用于食品的包装 | |
| B. | 利用碳酸酯聚合材料生产一次性饭盒可以减少对环境产生的白色污染 | |
| C. | 汽车尾气中的NO、CO等是汽油和柴油的不完全燃烧产物 | |
| D. | 部分烷烃常用于家庭烹饪的燃料气 |
5.现有0.1mol•L-1的醋酸溶液,下列说法正确的是( )
| A. | 加水稀释,溶液中所有离子的浓度都减小 | |
| B. | 溶液中n(CH3COO-)+n(CH3COOH)=0.1mol | |
| C. | 升高温度,醋酸的电离度增大 | |
| D. | 中和1L等物质的量浓度的NaOH溶液所消耗的醋酸体积大于1L |
15.某原电池装置如右图所示,电池总反应为2Ag+Cl2=2AgCl.下列说法正确的是( )


| A. | 正极反应为AgCl+e-═Ag+Cl- | |
| B. | 当电路中转移0.01mole-时,交换膜左侧溶液中约减少0.02mol离子 | |
| C. | 若用NaCl溶液代替盐酸,则电池总反应随之改变 | |
| D. | 放电时,交换膜右侧中有大量白色沉淀生成 |
2.关于下列各实验装置的叙述中,不正确的是( )


| A. | 装置①可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体 | |
| B. | 实验②放置一段时间后,小试管内有晶体析出 | |
| C. | 实验③振荡后静置,上层溶液颜色变浅 | |
| D. | 实验④可用于分离饱和Na2CO3溶液和CH3COOC2H5 |
11.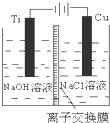 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控温不当易生成Cu而使Cu2O产率降低.
(2)方法Ⅰ制备过程会产生有毒气体,每生成1g该有毒气体,能量变化a kJ,写出制备反应的热化学方程式2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=+28akJ•mol-1.
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应式为2Cu-2e-+2OH-=Cu2O+H2O.
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O.
(5)方法Ⅲ可以用甲醛稀溶液替代肼,但因反应温度较高而使部分产品颗粒过大,过滤(填操作名称)可分离出颗粒过大的Cu2O.
(6)在相同的密闭容器中,用方法Ⅱ和方法Ⅲ制得的Cu2O分别进行催化分解水的实验:2H2O(g)$\frac{\underline{\;光照\;}}{Cu_{2}O}$2H2(g)+O2(g)△H>0水蒸气的浓度(mol•L-1)随时间t(min)变化如下表:
可以判断:实验①的前20 min的平均反应速率 ν(O2)=3.5×10-5 mol•L-1 min-1;实验温度T1<T2(填“>”、“<”);催化剂的催化效率:实验①<实验②(填“>”、“<”).
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法:2Cu+H2O $\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑ |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(2)方法Ⅰ制备过程会产生有毒气体,每生成1g该有毒气体,能量变化a kJ,写出制备反应的热化学方程式2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=+28akJ•mol-1.
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应式为2Cu-2e-+2OH-=Cu2O+H2O.
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O.
(5)方法Ⅲ可以用甲醛稀溶液替代肼,但因反应温度较高而使部分产品颗粒过大,过滤(填操作名称)可分离出颗粒过大的Cu2O.
(6)在相同的密闭容器中,用方法Ⅱ和方法Ⅲ制得的Cu2O分别进行催化分解水的实验:2H2O(g)$\frac{\underline{\;光照\;}}{Cu_{2}O}$2H2(g)+O2(g)△H>0水蒸气的浓度(mol•L-1)随时间t(min)变化如下表:
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
12.有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请回答问题.
(1)已知BA4E为离子化合物,是由NH4+、Cl-两种微粒构成的(填化学符号);
(2)B基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈纺锤形;
(3)某同学根据上述信息,推断C基态原子的核外电子排布为, ,该同学所画的电子排布图违背了泡利原理;
,该同学所画的电子排布图违背了泡利原理;
(4)D是P,E是Cl(填元素符号);
(5)G位于第Ⅷ族,G3+电子排布式为ls22s22p63s23p63d5;
(6)第二、三、四周期中与F同一族的所有元素分别与E元素形成化合物,其晶体的熔点由高到低的排列顺序为(写化学式)LiCl>NaCl>KCl,原因是LiCl、NaCl、KCl均为离子晶体,因为Li+、Na+、K+的半径依次增大,LiCl、NaCl、KCl的晶格能依次减小,故熔点依次降低.
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第八列 |
(2)B基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈纺锤形;
(3)某同学根据上述信息,推断C基态原子的核外电子排布为,
 ,该同学所画的电子排布图违背了泡利原理;
,该同学所画的电子排布图违背了泡利原理;(4)D是P,E是Cl(填元素符号);
(5)G位于第Ⅷ族,G3+电子排布式为ls22s22p63s23p63d5;
(6)第二、三、四周期中与F同一族的所有元素分别与E元素形成化合物,其晶体的熔点由高到低的排列顺序为(写化学式)LiCl>NaCl>KCl,原因是LiCl、NaCl、KCl均为离子晶体,因为Li+、Na+、K+的半径依次增大,LiCl、NaCl、KCl的晶格能依次减小,故熔点依次降低.