题目内容
16.下列反应:①氢氧化钠与硫酸,②一氧化碳与氧气,③八水合氢氧化钡与氯化铵,④金属铜与硝酸银.其中(用序号填空):能设计成原电池的反应是②④.分析 原电池反应必须是能自发进行的放热的氧化还原反应,所以只要是能自发进行的放热的氧化还原反应就能设计成原电池,据此分析解答.
解答 解:原电池反应必须是能自发进行的放热的氧化还原反应,所以只要是能自发进行的放热的氧化还原反应就能设计成原电池,
①氢氧化钠与硫酸发生中和反应,能自发进行且放热,但不是氧化还原反应,所以不能设计成原电池,故错误;
②一氧化碳与氧气生成二氧化碳,该反应能自发进行且是放热的氧化还原反应,所以能设计成原电池,故正确;
③八水合氢氧化钡与氯化铵是吸热反应,且不属于氧化还原反应,所以不能设计成原电池,故错误;
④金属铜与硝酸银发生置换反应,该反应能自发进行且是放热的氧化还原反应,所以能设计成原电池,故正确;
故选②④.
点评 本题考查原电池设计,明确原电池原理及原电池反应特点是解本题关键,注意原电池反应限制性条件“自发进行、放热、氧化还原反应”,知道常见反应的反应热、常见的氧化还原反应,题目难度不大.

练习册系列答案
相关题目
7.下列说法不正确的是( )
| A. | 锡中加入一定量的铅制成焊锡,目的使被焊接的部分更牢固,更不易被氧化 | |
| B. | 聚乙烯制成塑料薄膜,用于食品、药品包装的材料 | |
| C. | 大量燃烧化石燃料是造成雾霾天气的一种重要因素 | |
| D. | 含重金属离子的电镀废液不能随意排放 |
4.下列实验操作或结论有错误的是( )
| A. | 分液时,下层液体从分液漏斗下口放出,上层液体从上口倒出 | |
| B. | 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 | |
| C. | 蒸馏操作时,使用的冷凝水应该由低往高流,形成逆流 | |
| D. | 蒸发操作时,应使混合物中的水分子蒸干后,才能停止加热 |
8.某元素X的原子序数为52,下列叙述正确的是( )
| A. | X的主要化合价是-2、+4、+6 | |
| B. | 可以形成稳定的气态氢化物 | |
| C. | X的最高价氧化物对应水化物的酸性比HBrO4的酸性强 | |
| D. | X原子的还原性比碘原子强 |
7.下列离子方程式正确的是( )
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 向AlCl3溶液中加入过量的氨水溶液:Al3++3OH-═Al(OH)3↓ | |
| C. | 铁与氯化铁溶液反应:Fe+Fe3+═2Fe2+ | |
| D. | 铝与氢氧化钠溶液反应:2Al+2OH-+2H2O═2AlO2+3H2↑ |
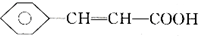 ),继而合成H的路线如下:
),继而合成H的路线如下: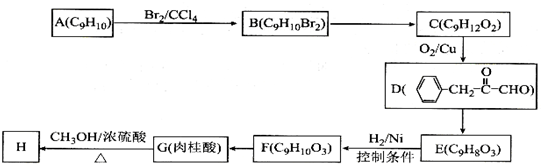
 ,D中含有官能团的名称为羰基、醛基;
,D中含有官能团的名称为羰基、醛基; +CH3OH$?_{△}^{浓硫酸}$
+CH3OH$?_{△}^{浓硫酸}$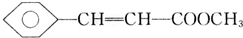 +H2O;
+H2O;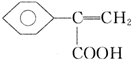 、
、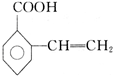 、
、 、
、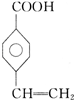 .
.