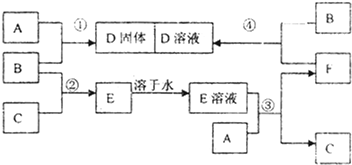
题目内容
3.在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)?3C(g)+nD(g),开始时A为4mol,B为6mol,5 min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol•L-1•min-1.计算:
(1)5min末A的物质的量浓度,
(2)B的转化率为.
(3)前5min内用B表示的化学反应速率v(B).
(4)化学方程式中n值.
分析 在容积为2L的密闭容器中,开始时A为4mol,B为6mol,5min末时测得C的物质的量为3mol,则:
A(g)+2B(g)?3C(g)+nD(g)
起始量(mol):4 6 0 0
变化量(mol):1 2 3 n
5min末(mol):3 4 3 n
(1)根据c=$\frac{n}{V}$计算5min末A的物质的量浓度;
(2)B的转化率=$\frac{△n(B)}{B的起始物质的量}$;
(3)根据v=$\frac{△c}{△t}$计算v(B);
(4)利用速率之比等于化学计量数之比计算n.
解答 解:在容积为2L的密闭容器中,开始时A为4mol,B为6mol,5min末时测得C的物质的量为3mol,则:
A(g)+2B(g)?3C(g)+nD(g)
起始量(mol):4 6 0 0
变化量(mol):1 2 3 n
5min末(mol):3 4 3 n
(1)5min末A的物质的量浓度为$\frac{3mol}{2L}$=1.5mol/L,
答:5min末A的物质的量浓度为1.5mol/L;
(2)B的转化率=$\frac{△n(B)}{B的起始物质的量}$×100%=$\frac{1mol}{4mol}×100%$=25%
答:B的转化率为25%.
(3)前5min内用B表示的化学反应速率v(B)=$\frac{\frac{2mol}{2L}}{5min}$=0.2mol/(L•min),
答:前5min内用B表示的化学反应速率为0.2mol/(L•min);
(4)速率之比等于化学计量数之比,则0.2mol/(L•min):0.2mol/(L•min)=2:n,故n=2,
答:n的值为2.
点评 本题考查化学平衡计算、反应速率计算,比较基础,旨在考查学生对基础知识的理解掌握.

| A. | 酒精溶液 | B. | 四氯化碳 | C. | 碘化钾溶液 | D. | 食盐水 |
①常温下NaNO2溶液的pH大于7;
②用某浓度的HNO2溶液作导电性实验,灯泡很暗;
③HNO2与NaCl不发生反应;
④0.1mol/L的HNO2溶液的pH为2.1.
| A. | ①② | B. | ③④ | C. | ①④ | D. | ②④ |
| A. | 金属钠保存在煤油中 | |
| B. | 存放FeSO4溶液时加入少量铁粉 | |
| C. | NaOH溶液保存在带胶塞的玻璃试剂瓶中 | |
| D. | 浓硝酸保存在无色细口瓶中 |
| A. | 用四氯化碳萃取碘水中的碘单质 | |
| B. | 蒸馏时,冷却水从冷凝管的下口通入,上口流出 | |
| C. | 用分液漏斗分液时,下层液体从下口放出,上层液体从上口倒出 | |
| D. | 分离油和水的混合物需要萃取,分液 |
| A. | Na+、MnO4-、K+、NO3- | B. | Na+、Mg2+、SO42-、Cl- | ||
| C. | Na+、Ba2+、OH-、NO3- | D. | K+、SO42-、HCO3-、Na+ |
 +H+=
+H+=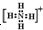 ;由5个原子核10个电子组成的化合物电子式是
;由5个原子核10个电子组成的化合物电子式是 ,结构式是
,结构式是 .
.