题目内容
用“>”、“<”或“=”填空:
(1)相同条件下,2mol氢原子所具有的能量 1mol氢分子所具有的能量.
(2)已知2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,碳的燃烧热 110.5kJ/mol
(3)已知常温时红磷比白磷稳定,比较下列反应中△H的大小:△H1 △H2.
①P4(白磷,s)+5O2(g)=2P2O5(s)△H1
②4P(红磷,s)+5O2(g)=2P2O5(s)△H2
(4)已知:稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,则98%的浓H2SO4与稀NaOH
溶液反应生成1mol水时,放出的热量 57.3kJ.
(5)在相同的温度下,发生反应:2SO2(g)+O2(g)?2SO3(g).若在体积不变的容器①中加入2mol SO2(g)和1mol O2 达到平衡时SO2的转化率为a;在压强不变的容器中加入2mol SO2(g)和1mol O2 达到平衡时SO2的转化率为b.则a b.
(1)相同条件下,2mol氢原子所具有的能量
(2)已知2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,碳的燃烧热
(3)已知常温时红磷比白磷稳定,比较下列反应中△H的大小:△H1
①P4(白磷,s)+5O2(g)=2P2O5(s)△H1
②4P(红磷,s)+5O2(g)=2P2O5(s)△H2
(4)已知:稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,则98%的浓H2SO4与稀NaOH
溶液反应生成1mol水时,放出的热量
(5)在相同的温度下,发生反应:2SO2(g)+O2(g)?2SO3(g).若在体积不变的容器①中加入2mol SO2(g)和1mol O2 达到平衡时SO2的转化率为a;在压强不变的容器中加入2mol SO2(g)和1mol O2 达到平衡时SO2的转化率为b.则a
考点:反应热和焓变,热化学方程式,化学平衡的计算
专题:化学反应中的能量变化,化学平衡专题
分析:(1)化学键断裂为吸热过程,新键生成放热的过程;
(2)燃烧热是1mol可燃物完全燃烧生成稳定的氧化物放出的热量;
(3)常温时红磷比白磷稳定,说明白磷能量高,反应放出的热量较多;
(4)浓硫酸稀释放热;
(5)由于该反应是气体体积减小的反应,反应后①中压强减小,②中压强不变,根据压强对平衡的影响分析.
(2)燃烧热是1mol可燃物完全燃烧生成稳定的氧化物放出的热量;
(3)常温时红磷比白磷稳定,说明白磷能量高,反应放出的热量较多;
(4)浓硫酸稀释放热;
(5)由于该反应是气体体积减小的反应,反应后①中压强减小,②中压强不变,根据压强对平衡的影响分析.
解答:
解:(1)氢气分子生成氢原子要破坏化学键,需要吸热,则2mol氢原子所具有的能量大于1mol氢分子所具有的能量,故答案为:>;
(2)燃烧热是1mol可燃物完全燃烧生成稳定的氧化物放出的热量,已知2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,则碳的燃烧热>110.5kJ/mol;
故答案为:>;
(3)常温时红磷比白磷稳定,说明白磷能量高,反应放出的热量较多,因△H<0,则放出的能量越多反应热越小,故答案为:<;
(4)稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,由于浓硫酸稀释放热,则98%的浓H2SO4与稀NaOH溶液反应生成1mol水时,放出的热量>57.3kJ;
故答案为:>;
(5)由于该反应是气体体积减小的反应,反应后①中压强减小,平衡逆向移动,SO2的转化率减小,②中压强不变,则②中压强比①中压强大,所以②中SO2的转化率比①中SO2的转化率大,所以若①容器中SO2的转化率为a,②的SO2的转化率将大于①的,即b>a;
故答案为:<.
(2)燃烧热是1mol可燃物完全燃烧生成稳定的氧化物放出的热量,已知2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,则碳的燃烧热>110.5kJ/mol;
故答案为:>;
(3)常温时红磷比白磷稳定,说明白磷能量高,反应放出的热量较多,因△H<0,则放出的能量越多反应热越小,故答案为:<;
(4)稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,由于浓硫酸稀释放热,则98%的浓H2SO4与稀NaOH溶液反应生成1mol水时,放出的热量>57.3kJ;
故答案为:>;
(5)由于该反应是气体体积减小的反应,反应后①中压强减小,平衡逆向移动,SO2的转化率减小,②中压强不变,则②中压强比①中压强大,所以②中SO2的转化率比①中SO2的转化率大,所以若①容器中SO2的转化率为a,②的SO2的转化率将大于①的,即b>a;
故答案为:<.
点评:本题综合考查反应热的大小比较以及影响化学平衡的因素,题目难度中等,注意把握比较反应热的角度,注意把握燃烧热、中和热的含义.

练习册系列答案
 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
氟利昂是一种氟氯代烃,以前常用作冰箱(柜)的制冷剂,现已禁止生产使用氟利昂做制冷剂的冰箱(柜),其主要原因是( )
| A、氟利昂化学性质稳定、有毒 |
| B、氟利昂会产生温室效应 |
| C、氟利昂会破坏臭氧层 |
| D、氟利昂会形成酸雨 |


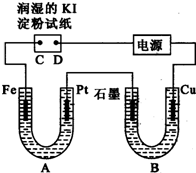 电解装置如图所示.图中B装置盛1L 3mol?L-1 K2SO4溶液,A装置中盛1L 3mol?L-1 AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.试回答:
电解装置如图所示.图中B装置盛1L 3mol?L-1 K2SO4溶液,A装置中盛1L 3mol?L-1 AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.试回答: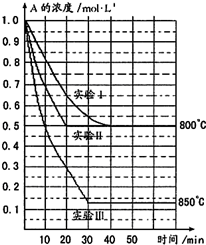 在一恒容密闭容器中发生某化学反应:2A(g)?B(g)+C(g)(A气体有颜色),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,B、C的起始浓度都为0,反应物A的浓度(mol?L-1)随时间(min)的变化如图所示:试回答下列问题:
在一恒容密闭容器中发生某化学反应:2A(g)?B(g)+C(g)(A气体有颜色),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,B、C的起始浓度都为0,反应物A的浓度(mol?L-1)随时间(min)的变化如图所示:试回答下列问题: