题目内容
13.工业制氯化铜时,将浓盐酸用蒸气加热至80℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁)反应如下:CuO+2HCl═CuCl2+H2O,FeO+2HCl═FeCl2+H2O.已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.(1)为除去溶液中的Fe2+,可以采用的方法是C
A.直接加碱,调整溶液pH≥9.6 B.加纯铜粉,将Fe2+还原出来
C.先将Fe2+氧化为Fe3+,再调整pH在3~4 D.通入硫化氢,使Fe2+直接沉淀
(2)工业上为除去溶液中的Fe2+,常使用NaClO,当向溶液中加入NaClO后,溶液pH变化情况是B
A.肯定减小 B.肯定增大 C.可能减小 D.可能增大
(3)若此溶液中只含有Fe3+时,要调整pH在3~4之间,此时最好向溶液中加入D
A.NaOH溶液 B.氨水 C.CuCl2溶液 D.CuO固体.
分析 (1)将Fe2+以Fe(OH)2形式完全沉淀,pH≥9.6,此时Cu2+以Cu(OH)2的形式完全沉淀,若将Fe2+氧化成Fe3+,Fe3+以Fe(OH)3形式完全沉淀,pH在3~4,此时Cu2+没有形成沉淀;
(2)NaClO为强碱弱酸盐,水解呈碱性,则加入NaClO,溶液的pH一定增大,另外NaClO可以酸反应生成HClO而导致溶液pH增大,氧化亚铁离子时会有氢离子参加,也导致溶液pH增大;
(3)使Fe3+转化为Fe(OH)3沉淀,应调节溶液的pH,所加物质能与酸反应,注意不能引入新杂质.
解答 解:(1)A.因直接加碱,调整溶液pH≥9.6,Fe2+以Fe(OH)2形式完全沉淀,此时的pH≥9.6,同时Cu2+以Cu(OH)2的形式完全沉淀,不但除去了Fe2+,也除去了Cu2+,不符合除杂的原则,故A错误;
B.因铜粉的还原性比铁弱,不能将Fe2+还原出来,故B错误;
C.将Fe2+氧化成Fe3+,Fe3+以Fe(OH)3形式完全沉淀,pH在3~4,此时Cu2+形成没有沉淀,过滤除去Fe(OH)3沉淀,既除去了杂质,也没有除去原物质,故C正确;
D.通入硫化氢,使Fe2+、Cu2+分别形成FeS沉淀,CuS沉淀,不但除去了Fe2+,也除去了Cu2+,不符合除杂的原则,故D错误;
故答案为:C;
(2)NaClO为强碱弱酸盐,水解呈碱性,则加入NaClO,溶液的pH一定增大,另外NaClO可以酸反应生成HClO而导致溶液pH增大,氧化亚铁离子时会有氢离子参加,也导致溶液pH增大,
故答案为:B;
(3)使Fe3+转化为Fe(OH)3沉淀,应调节溶液的pH,所加物质能与酸反应,注意不能引入新杂质,则则可用CuO 或Cu(OH)2或CuCO3,A、B均引入新杂质,C不能除杂,
故答案为:D.
点评 本题考查分离提纯实验的设计,为高频考点,把握物质的性质、氧化还原反应、盐类水解原理等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

 阅读快车系列答案
阅读快车系列答案(1)如用下图I装置制取氨气,可选择的试剂是浓氨水与氢氧化钠固体(或浓氨水与碱石灰或浓氨水与生石灰).
(2)制备氨基甲酸铵的装置如图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中. 当悬浮物较多时,停止制备.
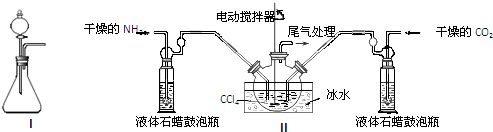
注:CCl4与液体石蜡均为惰性介质.
①发生器用冰水冷却的原因是降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解).液体石蜡鼓泡瓶的作用是通过观察气泡,调节NH3与CO2通入比例(或通过观察气泡,控制NH3与CO2的反应速率).
②从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称).为了得到干燥产品,应采取的方法是C(填写选项序号).
a.常压加热烘干 b.高压加热烘干 c.减压40℃以下烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种.
①设计方案,进行成分探究.
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解. | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置 | 溶液不变浑浊,证明固体中不含碳酸铵. |
| 步骤3:向试管中继续加入少量澄清石灰水. | 溶液变浑浊,证明固体中含有碳酸氢铵. |
[保留两位有效数字,已知Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(BaCO3)=197].
| A. | BaSO4?Ba2++SO42- | B. | HF═H++F- | ||
| C. | HI?H++I- | D. | NaHCO3═Na++HCO3- |
| A. | 溶液中导电粒子的数目增加,导电性增强 | |
| B. | 醋酸的电离程度增大,[H+]减小 | |
| C. | 电离平衡向右移动,电离常数Ka减少 | |
| D. | 稀释后溶液中由水电离出的[H+]=1×10-11 mol/L |
| A. | ClO3->BrO3->Cl2>Fe3+>I2 | B. | BrO3->Cl 2>ClO3->I2>Fe3+ | ||
| C. | BrO3->ClO3->Cl2>Fe3+>I2 | D. | BrO3->ClO3->Fe3+>Cl2>I2 |
| A. | 200ml 0.1mol/LFeCl3溶液 | B. | 100ml 0.1mol/L MgCl2溶液 | ||
| C. | 200ml 0.1mol/L NaCl溶液 | D. | 100ml 0.4mol/L BaCl2溶液 |
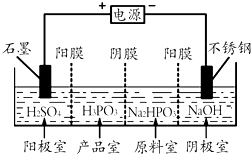 亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3?H++H2PO3-.亚磷酸与足量NaOH溶液反应,生成水和Na2HPO3.
亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3?H++H2PO3-.亚磷酸与足量NaOH溶液反应,生成水和Na2HPO3.