题目内容
19.25℃时,水的电离达到平衡,H2O?H++OH-△H>0,下列说法正确的是( )| A. | 向水中加入稀氨水,水的电离平衡逆向移动,c(OH-)减小 | |
| B. | 向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 | |
| C. | 向水中加入少量固体CH3COO Na,水的电离平衡逆向移动,c(H+)减小 | |
| D. | 将水加热,KW增大,pH不变 |
分析 A.酸或碱抑制水电离,一水合氨电离出氢氧根离子而抑制水电离;
B.硫酸氢钠完全电离生成氢离子而导致硫酸氢钠溶液呈强酸性,温度不变,离子积常数不变;
C.含有弱离子的盐促进水电离;
D.水的电离是吸热反应,升高温度促进水电离.
解答 解:A.酸或碱抑制水电离,一水合氨电离出氢氧根离子而使溶液中c(OH-)增大,抑制水电离,平衡逆向移动,故A错误;
B.硫酸氢钠完全电离生成氢离子而导致溶液中c(H+)增大,溶液中温度不变,KW不变,故B正确;
C.含有弱离子的盐促进水电离,醋酸根离子水解促进水电离,平衡逆向移动,故C错误;
D.水的电离是吸热反应,升高温度促进水电离,水的离子积常数增大,溶液的pH减小,故D错误;
故选B.
点评 本题考查弱电解质的电离,为高频考点,明确弱电解质电离特点及其水电离影响因素是解本题关键,离子积常数只与温度有关,与溶液酸碱性无关,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.对二甲苯 ( PX )是生产矿泉水瓶 (聚对苯二甲酸乙二酯,简称 PET )的必要原料,生产涉及的反应之一如下:
5 (PX)+12MnO4-+36H+→5
(PX)+12MnO4-+36H+→5  (PTA)+12Mn2++28H2O,下列有关说法错误的是( )
(PTA)+12Mn2++28H2O,下列有关说法错误的是( )
5
 (PX)+12MnO4-+36H+→5
(PX)+12MnO4-+36H+→5  (PTA)+12Mn2++28H2O,下列有关说法错误的是( )
(PTA)+12Mn2++28H2O,下列有关说法错误的是( )| A. | PTA 是该反应的氧化产物 | |
| B. | PTA 与乙二醇通过缩聚反应即可生产 PET 塑料 | |
| C. | PX 分子含有苯环的同分异构体还有 3 种 | |
| D. | 该反应消耗 1molPX,共转移 10mol电子 |
10.下列说法不正确的是( )
| A. | 构成有机物的骨干元素是碳 | |
| B. | 构成地壳的骨干元素是Si,在二氧化硅晶体中每个Si原子周围结合4个O原子,每个O原子周围结台2个Si原子,[SiO4]四面体向空间无限伸展,形成立体网状结构 | |
| C. | 单质Si是制作计算机芯片的主要材料,SiO2是制取光导纤维的主要材料 | |
| D. | 空气中含量最大的元素是N.海水中含量最大的元索是C1,太阳系中含量最大的元素是H |
14.常温下,物质的量浓度相同的下列溶液中,符合pH由小到大顺序排列的是( )
| A. | Na2CO3 NaHCO3 NaCl NH4Cl | B. | NaHCO3 Na2CO3 NH4Cl NaCl. | ||
| C. | NH4Cl (NH4)2SO4 Na2S NaNO3 | D. | (NH4)2SO4 NH4Cl NaNO3 NaHCO3 |
8.如图所示装置在常温下工作(溶液体积变化忽略不计),闭合K,灯泡发光,下列叙述中不正确的是( )
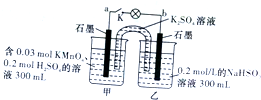

| A. | 电池工作时,甲烧杯中由烧杯中由水电离出的c(H+)逐渐减小 | |
| B. | 电池工作时,盐桥中的“K+”移向甲烧杯,外电路的方向是从b到a | |
| C. | 当电路中有1.204×1021个电子转移时,乙烧杯中溶液的pH约为2 | |
| D. | 乙池中的氧化产物为SO${\;}_{4}^{2-}$ |
13.在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体d,呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是( )
| a(干燥气体) | b(液体) | 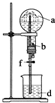 | |
| A | NO | 水 | |
| B | CO2 | 4mol•L-1NaOH溶液 | |
| C | Cl2 | 饱和NaCl溶液 | |
| D | NH3 | 热的浓的NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
 CH3COOCH2CH3+H2O;苯制取环己烷:
CH3COOCH2CH3+H2O;苯制取环己烷: .
.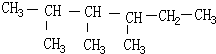 2,3,4-三甲基己烷,
2,3,4-三甲基己烷,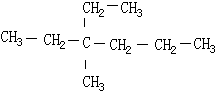 3-甲基-3-乙基己烷,
3-甲基-3-乙基己烷,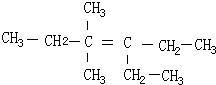 3,3-二甲基-4-乙基-3-己烯,
3,3-二甲基-4-乙基-3-己烯,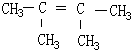 2,3-二甲基-2-丁烯.
2,3-二甲基-2-丁烯.