题目内容
14.某羧酸酯的分子式为C18H26O5,1mol该酯完全水解可得到1mol羧酸和2mol乙醇,该羧酸的分子式为( )| A. | C16H22O5 | B. | C14H16O4 | C. | C14H18O5 | D. | C14H20O5 |
分析 1mol该酯完全水解可得到1mol羧酸和2mol乙醇,则说明酯中含有2个酯基,结合酯的水解特点以及质量守恒定律判断该羧酸的分子式.
解答 解:某羧酸酯的分子式为C18H26O5,1mol该酯完全水解可得到1mol羧酸和2mol乙醇,说明酯中含有2个酯基,设羧酸为M,
则反应的方程式为C18H26O5+2H2O=M+2C2H6O,
由质量守恒可知M的分子式为C14H18O5,
故选C.
点评 本题考查有机物分子式的确定,为高频考点,题目难度不大,把握酯化反应中碳原子个数变化、官能团的变化为解答关键,侧重酯的性质的考查,试题有利于提高学生的分析能力及灵活应用能力.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
4.某同学拟用粗氧化铜(含少量氧化亚铁及不溶于酸的杂质)制取无水氯化铜,流程如图所示:
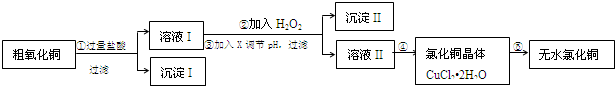
(1)步骤①中氧化铜与盐酸反应的离子方程式:CuO+2H+=Cu2++H2O.
(2)步骤②中加入H2O2的是为了将Fe2+氧化成Fe3+,Fe2+与H2O2在酸性溶液中反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)已知:
步骤③中调节pH的最佳范围为3.2-4.7,
步骤③中可以用于调节溶液pH的试剂X是bc:
a.NaOH b.CuO c. Cu(OH)2 d.NH3•H2O
(4)步骤⑤中要得到无水CuCl2,需要在干燥的HCl气流中加热CuCl2•2H2O,原因是在干燥的HCl气流中抑制Cu2+的水解,且带走CuCl2•xH2O受热产生的水气,故能得到无水氯化铜.

(1)步骤①中氧化铜与盐酸反应的离子方程式:CuO+2H+=Cu2++H2O.
(2)步骤②中加入H2O2的是为了将Fe2+氧化成Fe3+,Fe2+与H2O2在酸性溶液中反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| Fe2+ | 7.0 | 9.0 |
步骤③中可以用于调节溶液pH的试剂X是bc:
a.NaOH b.CuO c. Cu(OH)2 d.NH3•H2O
(4)步骤⑤中要得到无水CuCl2,需要在干燥的HCl气流中加热CuCl2•2H2O,原因是在干燥的HCl气流中抑制Cu2+的水解,且带走CuCl2•xH2O受热产生的水气,故能得到无水氯化铜.
5.下列不属于混合物的是( )
| A. | 液氯 | B. | 漂白粉 | C. | 盐酸 | D. | 碘酒 |
2.下列情况可引起大气污染的是( )
①煤的燃烧
②工业尾气的任意排放
③燃放鞭炮
④汽车尾气.
①煤的燃烧
②工业尾气的任意排放
③燃放鞭炮
④汽车尾气.
| A. | 只有①② | B. | 只有② | C. | 只有②④ | D. | ①②③④ |
9.由一种阳离子和两种酸根离子组成的盐称为混盐.下列关于混盐Na4S2O3的有关判断,不正确的是( )
| A. | 该混盐能使高锰酸钾酸性溶液褪色 | |
| B. | 该混盐溶液加入BaCl2可以生成沉淀 | |
| C. | 该混盐与H2SO4反应有气体生成 | |
| D. | 该混盐在酸性条件下可生成S,每产生1molS转移1.5NA个电子 |
19.光纤通信的光学纤维是由下列哪种物质经特殊工艺制成的( )
| A. | 碳 | B. | 二氧化硅 | C. | 铜 | D. | 硅 |
6.在1000K时,已知反应Ni(s)+H2O(g)?NiO(s)+H2(g)的平衡常数K=0.0059.当水蒸气和氢气的物质的量浓度相等时,此反应( )
| A. | 已达平衡状态 | B. | V正>V逆 | ||
| C. | 未达平衡状态,平衡逆向移动 | D. | 无法确定是否达到平衡状态 |
3.在25℃的纯水中通入一定量的氯化氢,当溶液的pH=1时,则由水电离出的c(H+)是( )
| A. | 1×10-1mol/L | B. | 1×10-6mol/L | C. | 1×10-3mol/L | D. | 1×10-13mol/L |
4.下列物质分类正确的是( )
| A. | SO2、SiO2、CO均为酸性氧化物 | B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | ||
| C. | 盐酸、水玻璃、氨水均为混合物 | D. | 烧碱、冰醋酸、四氯化碳均为电解质 |