题目内容
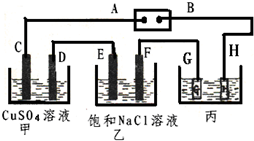 如图所示的装置,C、D、E、F都是惰性电极.将电源接通后,向乙中滴入酚酞试液.在F极附近显红色.试回答以下问题:
如图所示的装置,C、D、E、F都是惰性电极.将电源接通后,向乙中滴入酚酞试液.在F极附近显红色.试回答以下问题:①电极A的名称是
②甲装置中D电极的电极反应式:
③在25℃时若用惰性电极电解饱和 NaCl溶液一段时间,当阳极产生5.6L(标准状况下)一种气体,电解后溶液体积为50L时,求所得溶液在25℃时的氢氧化钠物质的量浓度=
④欲用丙装置给铜镀银,G应该是
考点:电解原理
专题:
分析:①电解饱和食盐水时,酚酞变红的极是阴极,阴极和电源负极相连;
②电解甲溶液时,阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成铜;
③根据电解反应方程式可以计算;
④电镀时,镀层作阳极,镀件作阴极,电解质溶液中的金属元素与阳极材料所含元素相同.
②电解甲溶液时,阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成铜;
③根据电解反应方程式可以计算;
④电镀时,镀层作阳极,镀件作阴极,电解质溶液中的金属元素与阳极材料所含元素相同.
解答:
解:①向乙中滴入酚酞试液,在F极附近显红色,说明该极上氢离子放电,所以该电极是阴极,所以E电极是阳极,D电极是阴极,C电极是阳极,G电极是阳极,H电极是阴极,X电极是阳极,Y是阴极,A是电源的正极,B是原电池的负极,故答案为:正极;
②电解甲溶液时,阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成铜,电极反应式Cu2++2e-═Cu,故答案为:Cu2++2e-═Cu;
③电解饱和食盐水的电解原理是2NaCl+2H2O
2NaOH+H2↑+Cl2↑,阳极产生5.6L(标准状况下)一种气体即氯气的物质的量为:
=0.25mol,所以根据方程式生成氢氧化钠为0.5mol,所以氢氧化钠物质的量浓度
=0.01 mol/l,故答案为:0.01 mol/l;
④在铜上镀银时,G作阳极,镀层银作阳极,所以G的材料是银,电解质溶液是硝酸银溶液,故答案为:银;AgNO3.
②电解甲溶液时,阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成铜,电极反应式Cu2++2e-═Cu,故答案为:Cu2++2e-═Cu;
③电解饱和食盐水的电解原理是2NaCl+2H2O
| ||
| 5.6 |
| 22.4 |
| 0.5 |
| 50 |
④在铜上镀银时,G作阳极,镀层银作阳极,所以G的材料是银,电解质溶液是硝酸银溶液,故答案为:银;AgNO3.
点评:本题考查了电解原理,明确电解池溶液中阴阳离子的放电顺序是解本题的关键,注意:如果活泼金属作电解池阳极时,阳极上金属失电子而不是溶液中阴离子失电子,为易错点.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目
下列装置能达到实验目的是( )
A、 用于放出碘的四氯化碳溶液 |
B、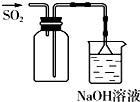 用于实验室收集SO2 |
C、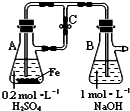 用于实验室制备Fe(OH)2 |
D、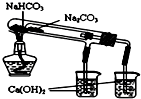 用于比较NaHCO3和Na2CO3 |
下列除去杂质的试剂正确的是( )
①除去CH4中少量C2H4:酸性KMnO4溶液
②除去乙酸乙酯中的少量乙酸:饱和Na2CO3溶液
③除去CO2中少量SO2:饱和Na2CO3溶液
④除去C2H2中少量H2S:CuSO4溶液
⑤除去溴苯中混有的少量溴:NaOH溶液.
①除去CH4中少量C2H4:酸性KMnO4溶液
②除去乙酸乙酯中的少量乙酸:饱和Na2CO3溶液
③除去CO2中少量SO2:饱和Na2CO3溶液
④除去C2H2中少量H2S:CuSO4溶液
⑤除去溴苯中混有的少量溴:NaOH溶液.
| A、②③④⑤ | B、②④⑤ |
| C、①②④⑤ | D、③④⑤ |
2010年1月12日海地当地时间16时53分(北京时间1月13日5时53分),海地遭遇500年来最强地震,在抗震救灾中要用大量漂白粉和漂白液杀菌消毒.下列说法中正确的是( )
| A、漂白粉是纯净物,漂白液是混合物 |
| B、漂白粉的有效成分是Ca(ClO)2 |
| C、工业上将氯气通入澄清石灰水制取漂白粉 |
| D、漂白液的有效成分是Na2O2 |
下列溶液中各微粒的浓度关系不正确的是( )
| A、0.1mol?L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) |
| B、0.1mol?L-1 NH4Cl溶液中:c(NH4+)+c(NH3?H2O)=c(Cl-) |
| C、0.1mol?L-1NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)=c(HCO3-)+c(CO32-)+c(OH-) |
| D、等体积、等物质的量浓度的CH3COONa和弱酸CH3COOH混合后的溶液中:c(CH3COO-)-c(CH3COOH)=2c(H+)-2c(OH-) |
“酸雨”的形成主要是由于( )
| A、森林遭到乱砍伐,破坏了生态平衡 |
| B、工业上大量燃烧含硫的燃料 |
| C、大气中CO2的含量增多 |
| D、汽车排出大量尾气 |