题目内容
用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成.
(1)Al的原子结构示意图为 ; SiO2的晶体类型为 .
(2)Al3+与Yn-的电子数相同,Y所在族的各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是 .
(3))焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是 .
(4经处理后的熔渣36.0g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0g固体;滤液中加入过量NaOH溶液,分离得到21.4g固体;则此熔渣中Al2O3的质量分数为 .
(1)Al的原子结构示意图为
(2)Al3+与Yn-的电子数相同,Y所在族的各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是
(3))焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是
(4经处理后的熔渣36.0g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0g固体;滤液中加入过量NaOH溶液,分离得到21.4g固体;则此熔渣中Al2O3的质量分数为
考点:原子结构示意图,不同晶体的结构微粒及微粒间作用力的区别,镁、铝的重要化合物,有关混合物反应的计算
专题:化学键与晶体结构
分析:(1)铝是13号元素,原子核外有13个电子,根据电子排布规律写出原子结构示意图;
(2)在元素周期表中只有第ⅦA族卤素原子的氢化物的水溶液才均显酸性,根据影响分子晶体的熔沸点高低的因素判断熔沸点高低,进一步推断物质;
(3)由药皮的成分和物质的性质进行推断产生的使金属不被氧化的气体成分;
(4)36.0g(仅含Fe2O3、Al2O3、SiO2)加入足量稀盐酸,二氧化硅不和盐酸反应,所以分离得到11.0g的固体是二氧化硅,滤液中加入过量NaOH溶液,分离得到21.4g固体是氢氧化铁,根据铁原子守恒计算氧化铁的质量,剩余的质量就是氧化铝,再根据质量分数公式进行计算.
(2)在元素周期表中只有第ⅦA族卤素原子的氢化物的水溶液才均显酸性,根据影响分子晶体的熔沸点高低的因素判断熔沸点高低,进一步推断物质;
(3)由药皮的成分和物质的性质进行推断产生的使金属不被氧化的气体成分;
(4)36.0g(仅含Fe2O3、Al2O3、SiO2)加入足量稀盐酸,二氧化硅不和盐酸反应,所以分离得到11.0g的固体是二氧化硅,滤液中加入过量NaOH溶液,分离得到21.4g固体是氢氧化铁,根据铁原子守恒计算氧化铁的质量,剩余的质量就是氧化铝,再根据质量分数公式进行计算.
解答:
解:(1)Al在周期表中位于第三周期第ⅢA族,Al原子核外共13个电子,铝原子的原子结构示意图为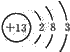 ;
;
SiO2通过共价键形成的晶体,其熔点高、硬度大,属于原子晶体,
故答案为: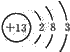 ;原子晶体;
;原子晶体;
(2)在元素周期表中只有第ⅦA族卤素原子的氢化物的水溶液才均显酸性,因为Al3+与Yn-的电子数相同,所以Y是F元素.卤素元素形成的氢化物均属于分子晶体,其沸点随分子间作用力的增大而升高,但由于HF分子中存在氢键,因而HF的沸点最高,所以沸点最低的是HCl,
故答案为:HCl;
(3)由药皮的成分大理石、水泥、硅铁可知,在高温下只有大理石才分解产生CO2,因此气体只能是CO2气体,
故答案为:CO2;
(4)熔渣中只有SiO2与盐酸不反应,因此11.0g是SiO2的质量.Fe2O3、Al2O3溶于盐酸分别生成FeCl3、AlCl3,当滤液中加入过量NaOH溶液时AlCl3生成NaAlO2,FeCl3生成Fe(OH)3沉淀.所以21.4g固体是Fe(OH)3的质量,其物质的量为:
=0.2mol,由铁原子守恒知Fe2O3的物质的量为0.1mol,其质量为0.1mol×160g?mol-1=16.0g,
熔渣中Al2O3的质量分数为
×100%=25%,
故答案为:25%.
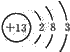 ;
; SiO2通过共价键形成的晶体,其熔点高、硬度大,属于原子晶体,
故答案为:
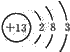 ;原子晶体;
;原子晶体;(2)在元素周期表中只有第ⅦA族卤素原子的氢化物的水溶液才均显酸性,因为Al3+与Yn-的电子数相同,所以Y是F元素.卤素元素形成的氢化物均属于分子晶体,其沸点随分子间作用力的增大而升高,但由于HF分子中存在氢键,因而HF的沸点最高,所以沸点最低的是HCl,
故答案为:HCl;
(3)由药皮的成分大理石、水泥、硅铁可知,在高温下只有大理石才分解产生CO2,因此气体只能是CO2气体,
故答案为:CO2;
(4)熔渣中只有SiO2与盐酸不反应,因此11.0g是SiO2的质量.Fe2O3、Al2O3溶于盐酸分别生成FeCl3、AlCl3,当滤液中加入过量NaOH溶液时AlCl3生成NaAlO2,FeCl3生成Fe(OH)3沉淀.所以21.4g固体是Fe(OH)3的质量,其物质的量为:
| 21.4g |
| 107g/mol |
熔渣中Al2O3的质量分数为
| (36.0-11.0-16.0)g |
| 36.0g |
故答案为:25%.
点评:本题考查原子的结构、晶体类型以及有关计算,题目较为综合,本题中注意把握判断晶体类型以及晶体熔沸点高低的方法,试题培养学生的书写、理解能力及化学计算能力.

练习册系列答案
相关题目
下列说法错误的是( )
| A、配制FeCl3溶液,为了抑制水解,常加盐酸 |
| B、盐类都能水解 |
| C、盐类水解通常都是吸热的 |
| D、水解达到平衡时的AlCl3稀溶液中,无论再加入饱和AlCl3溶液还是加水或者加热,其水解平衡均向正向移动 |
已知R+核外有18个电子.则R元素位于元素周期表的( )
| A、第三周期第ⅤA族 |
| B、第四周期第ⅠA族 |
| C、第五周期第ⅢA族 |
| D、第四周期第ⅤA族 |
若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,可能共存的是( )
| A、NH4+、CO32-、K+、Na+ |
| B、Na+、Ba2+、Cl-、HCO3- |
| C、NO3-、Cu2+、K+、SO42- |
| D、NO3-、K+、CO32-、OH- |
最近研制出一种新材料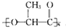 ,它能代替聚苯乙烯.它是由乳酸(一种有机酸)缩聚而成,能在乳酸菌的作用下降解而不会污染环境.下列关于聚乳酸的说法正确的是( )
,它能代替聚苯乙烯.它是由乳酸(一种有机酸)缩聚而成,能在乳酸菌的作用下降解而不会污染环境.下列关于聚乳酸的说法正确的是( )
 ,它能代替聚苯乙烯.它是由乳酸(一种有机酸)缩聚而成,能在乳酸菌的作用下降解而不会污染环境.下列关于聚乳酸的说法正确的是( )
,它能代替聚苯乙烯.它是由乳酸(一种有机酸)缩聚而成,能在乳酸菌的作用下降解而不会污染环境.下列关于聚乳酸的说法正确的是( )| A、聚乳酸是一种纯净物 |
B、聚乳酸的单体是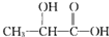 |
| C、聚乳酸是一种羧酸 |
| D、聚乳酸是由其单体通过加聚反应合成的 |

 (1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气,写出该反应的离子方程式
(1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气,写出该反应的离子方程式
