题目内容
14.425℃时,在1L密闭容器中充入下列气体物质进行反应达到平衡,分析如图所示的示意图,从下列选项中选出不能从示意图中读出的相关信息( )
| A. | 同温同压下,只要物质比例适当,从正、逆方向都可以建立同一平衡状态 | |
| B. | 图甲表示的反应为H2(g)+I2(g)?2HI(g) | |
| C. | 图甲中H2的转化率+图乙中HI的转化率=100% | |
| D. | 相同条件下,分别从正、逆方向建立等同的平衡状态,所需时间相同 |
分析 根据图甲可以看出,H2和I2逐渐减小直到不变,而HI逐渐增大直到不变,图乙可以看出,HI逐渐减小直到不变,而H2和I2逐渐增大直到不变,并且最终2个平衡状态时一样的,则属于等效平衡,据此分析.
解答 解:A、由图甲可以看出,由H2和I2反应生成HI,图乙可以看出,由HI分解生成H2和I2,最终2个平衡状态时一样的,故A正确;
B、由图甲可以看出,H2和I2反消耗1-0.21=0.79,则生成HI为1.58,所以甲表示的反应为H2(g)+I2(g)?2HI(g),故B正确;
C、由图甲可以看出,由H2和I2反应生成HI,图乙可以看出,由HI分解生成H2和I2,最终2个平衡状态时一样的,则属于等效平衡,所以图甲中H2的转化率+图乙中HI的转化率=100%,故C正确;
D、相同条件下,分别从正、逆方向建立等同的平衡状态,反应时间与速率有关,所以不能判断所需时间是否相同,故D错误;
故选:D.
点评 本题主要考查了等效平衡的应用,难度不大,注意基础知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.已知NA为阿伏加徳罗常数的数值,下列说法正确的是( )
| A. | 56g铁在足量氧气中燃烧,转移的电子数为2NA | |
| B. | 1g氢气含有NA个氢气分子 | |
| C. | 标准状况下,22.4 L水含有1 mol水分子 | |
| D. | 2 mol钠与过量稀盐酸反应生成NA个氢气分子 |
12.化学与生产、生活密切相关.下列有关说法正确的是( )
| A. | 化学危险品易危害人类,应禁止生产 | |
| B. | 汽车尾气是目前城市大气污染产生的一个重要来源 | |
| C. | 氢氧化钠和氢氧化铝都可用于治疗胃酸过多 | |
| D. | 漂白粉长期放置在空气中不会变质 |
19.ClO2是一种新型灭菌剂.工业上用NaClO3、Na2SO3和稀硫酸反应来制取ClO2,反应中Na2SO3被NaClO3氧化生成Na2SO4,NaClO3被还原生成ClO2.假设上述三种反应物恰好完全反应,则所得的产物中Na+和SO42-物质的量之比为( )
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 2:3 |
6.短周期主族元素Q、W、X、Y、Z原子序数依次增大,Q原子的最外层电子数是其内层电子总数的3倍,W是非金属性最强的元素,X的原子半径在短周期主族元素中为最大,Y是地壳中含量最多的金属元素,Z与Q同主族.下列叙述正确的是( )
| A. | 原子半径;r(Z)>r(W)>r(Q) | |
| B. | 气态氢化物的热稳定性:W>Q>Z | |
| C. | X与Z形成的化合物呈碱性的原因:Z2-+2H2O?H2Z+2OH- | |
| D. | Y与Z的二元化合物可以在溶液中通过复分解反应制得 |
3.下列离子在溶液中能大量共存的是( )
| A. | Fe3+、NH4+、SCN-、Cl- | B. | Na+、OH-、NO3-、HCO3- | ||
| C. | OH-、Ba2+、Na+、AlO2- | D. | Fe3+、NH4+、Cl-、OH- |
4.2016年8月16日,长征二号丁运载火箭成功将“墨子号”量子科学实验卫星发射到预定轨道,火箭发射时燃料会发生反应:C2H5N2+2N2O4═2CO2↑+4H2O+3N2↑,下列关于该反应的说法错误的是( )
| A. | 该反应的△S<0 | B. | 该反应的△H<0 | ||
| C. | 该反应是不可逆反应 | D. | 该反应产物不会造成大气污染 |
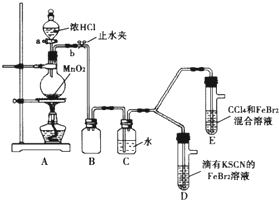 某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验: